XiaoMi-AI文件搜索系统
World File Search System研究衰老中的分子脑衰老 -
摘要:随着衰老社会的发展,认知老化已成为需要关注的紧迫关注。衰老加速的小鼠易发8(SAMP8)模型已被证明是研究认知衰老的早期阶段。通过对脑皮质的分子变化进行广泛的检查,利用整体基因组转录组学,我们的主要目标是通过治疗应用来揭示潜在的分子靶标,并且与药物筛查相关。我们的研究涵盖了四个不同的条件,比较了不同时间点(1年对16周)和跨不同菌株(SAMP8 vs. SAMR1)的相同应变,即:生理衰老,加速衰老,加速衰老的早期事件以及加速衰老的后期事件。着眼于与大脑衰老有关的关键功能改变,包括神经发生,突触动力学,神经代谢和神经蛋白流量,我们确定了与这些过程相关的候选基因。此外,采用蛋白质 - 蛋白质相互作用(PPI)分析,我们确定了参与这些功能域内相互作用的枢轴枢纽基因。此外,基因 - 基因扰动分析使我们能够发现在四种条件下表现出激活或抑制的潜在上游基因或转录因子。总之,我们通过全基因组转录组学对SAMP8小鼠大脑的全面分析不仅加深了我们对与年龄相关的变化的理解,而且为预测模型奠定了基础,以促进认知衰老的药物筛查。
PRKDC:检查点阻断免疫疗法的新生物标志物和药物靶点
摘要背景免疫检查点阻断可有效治疗各种恶性肿瘤。识别预测性生物标志物以协助患者选择免疫疗法已成为临床和研究环境中的优先事项。方法通过下一代测序识别对免疫疗法有反应的患者的突变。使用来自 Cancer Genome Atlas 的数据集分析了蛋白激酶、DNA 活化催化多肽 (PRKDC) 突变、突变负荷和微卫星不稳定性 (MSI) 之间的关系。通过进行体外研究和使用 34 名胃癌患者的组织样本验证了这些关系。CT26 动物模型用于评估 PRKDC 作为预测生物标志物的作用和 DNA-PK 抑制剂的疗效。结果从已发表的文献中,我们发现在肿瘤携带 PRKDC 突变的患者中,分别有 75%、53.8% 和 50% 的肺癌、黑色素瘤和肾细胞癌患者对免疫疗法有反应。这些突变大多是截短的,位于功能域或不稳定的PRKDC蛋白结构中。进一步分析表明,PRKDC突变与宫颈癌、结肠腺癌、头颈部鳞状细胞癌、肺腺癌、胃腺癌和子宫内膜癌中的高突变负荷显着相关。携带PRKDC突变的胃癌或结肠癌患者也与MSI-high状态高度相关。最后,我们发现敲除PRKDC或DNA-PK抑制剂(PRKDC编码DNA依赖性蛋白激酶的催化亚基)增强了抗程序性细胞死亡蛋白1途径单克隆抗体在CT26动物模型中的疗效。结论PRKDC不仅是一个预测生物标志物,也是免疫检查点抑制剂的药物靶点。
提高四级护理转诊中心外显子组测序的有效性:罕见神经遗传疾病中的新突变、临床表现和诊断挑战
摘要 背景 我们采用多模式方法,包括详细表型分析、全外显子组测序 (WES) 和候选基因过滤器,对三级神经病学中心转诊的个体进行罕见神经系统疾病诊断。方法 使用候选基因过滤器和严格的算法对 66 名患有神经遗传疾病的个体进行 WES,以评估序列变异。使用计算机预测工具、家族分离分析、先前的疾病关联出版物和相关生物学检测来解释致病或可能致病的错义变异。结果 39% (n=26) 的病例实现了分子诊断,其中包括 59% 的儿童期发病病例和 27% 的晚发型病例。总体而言,37% (10/27) 的肌病、41% (9/22) 的神经病变、22% (2/9) 的 MND 和 63% (5/8) 的复杂表型得到了基因诊断。已鉴定出 27 种与疾病相关的变异,包括 FBXO38、LAMA2、MFN2、MYH7、PNPLA6、SH3TC2 和 SPTLC1 中的 10 种新变异。单核苷酸变异 (n=10) 影响功能域内的保守残基和先前鉴定的突变热点。已确定的致病变异 (n=16) 表现出非典型特征,例如成人多聚葡聚糖体病的视神经病变、脑腱黄瘤病的面部畸形和骨骼异常、先天性肌无力综合征 10 的类固醇反应性虚弱。诊断出可能可治疗的罕见疾病,改善了部分患者的生活质量。结论 整合深度表型分析、基因过滤算法和生物检测提高了外显子组测序的诊断产量,发现了新的致病变异,并扩展了门诊环境中难以诊断的罕见神经遗传疾病的表型。
CRISPR 筛选:研究病毒的分子工具——...
病毒是专性病原体,利用宿主细胞机制进行复制。宿主细胞可以识别病毒并激活抗病毒反应。揭示影响病毒感染的因素有助于发现新的候选药物。使用有助于抗病毒免疫反应的特异性免疫激动剂是治疗感染的另一种方法。最近,使用新的综合分子工具(例如成簇的规律间隔的短回文重复序列 (CRISPR) 筛选)研究宿主细胞相互作用并确定开发新抗病毒药物的关键靶标已成为可能。在过去十年中,CRISPR/CRISPR 相关蛋白 (Cas) 系统已被用于基因组编辑。仅当基因组靶标后面跟着一个原间隔区相邻基序 (PAM) 序列(Cas9 蛋白为 NGG,Cas12a 蛋白为 TTTV)时,Cas 蛋白才会使用 II 型 CRISPR 系统中的单向导 RNA (sgRNA) 和 V 型系统中的 CRISPR RNA (crRNA)(为简单起见,在本综述中称为 gRNA)识别靶位点。在识别靶位点后,Cas 蛋白会解开 DNA 链,形成 R 环结构,并切断两条链,导致 DNA 双链断裂 (DSB)。利用位点特异性诱变,已经生成了具有核酸酶钝结构域的 Cas 内切酶变体,称为核酸酶失活 Cas (dCas) 蛋白。dCas 保留了结合目标位点的能力,但不能将 DSB 引入 DNA。将不同的功能域融合到 dCas 蛋白上,可将其转化为具有多种功能的分子“瑞士军刀”,例如单核苷酸编辑和调节转录和表观遗传学 [1]。通过不同的 CRISPR/Cas 系统激活或抑制靶基因转录已被广泛用于破坏单个基因和研究病毒-宿主相互作用 [2]。通过设计和合成数千个针对多个目标基因或基因组中所有基因的 gRNA,可以使用 CRISPR/Cas
引用Corcuff M,Garibal M,Desvignes J-P,Guien C,Grattepanche C,Collod-BéroudG,MénoretE,Salgado D和BéroudC(2023),Prove
分类(Yorczyk等,2015; Kim等,2019),主要与ACMG AMP准则准则允许的主观性和不确定性程度有关。他们建议在解释过程中使用28个标准来区分:良性(可能是良性)的意义(VUS),可能是致病性和致病性变体。但是,仅在临床实践中获得这些标准的一部分,并且必须使用带注释的变体集合。为提供这样的资源,已经制定了各种倡议,包括Clinvar(Landrum等,2016),Clingen(Savatt等,2018),Varsome(Kopanos等,2019)和Intervar(Li and Wang,2017)。这些从专家和各种资源中收集数据,并可以为未报告的变体提供解释。然而,此自动化过程有时可能会产生不适当的结果,并且应谨慎查看数据。,如果我们专注于分类证据,一方面,最具挑战性的标准之一是PM1“位于突变的热点和/或关键和完善的功能域(例如,酶的活性位点),没有良性变化”,这是在报告的病例中使用的约10%(Amendola等人,2016年)。要提取此信息,自动化系统主要依赖Uniprot(Uniprot联盟。2017)和“ dbnsfp31a_interpro”,该数据库是DBNSFP(Liu等,2011; Liu等,2016)和Interpro(Mitchell等,2019)的域信息数据库,可在蛋白质家族,域,域和功能性点上包含有关蛋白质家族和功能性的信息。已经使用保守域数据库(CDD)(Marchler-Bauer等,2015)制定了其他计划,例如Subrvis分数(Gussow等,2016),旨在评估基因子区域对变体的不耐受性。通常,PM1标准与突变簇的功能区域的广泛视图相关联。然而,很难使用,因为这种聚类的定义不足和理解,如其在Vasome中的各种解释所示(Kopanos等人,2019年)和Intervar(Li and Wang,2017)。它也可能受到基因非人类疾病的兴趣和分类的变异次数的高度偏见。另一方面,最常用的证据是PM2/BA1/BS1“人口数据库中缺失的变异或等位基因频率太高,对于该疾病而言,据报道约有50%的病例(Amendola等人,2016年)。该标准的假设非常简单:如果已报告了普通人群频率高的变体,则不能是一种罕见的致病变异,否则该疾病的频率将更高;如果从未报道过变体,或者频率很低,则可能是一种罕见的致病变异。这些信息从大尺度基因组/外显子组测序项目中很大,大多数人从侏儒(Koch,2020年)或人口数据库中收集了这些信息,例如阿巴拉姆(巴西人人口)(Naslavsky等人)(Naslavsky等人,更大的Midder Midder eali Milder Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide Elide eLDEL,202)人口)(Scott等,2016)。然而,人类进化不允许变异的基因组饱和,其中一些在遗传漂移引起的人群中非常罕见(Bach,2019)。的确,如果人口足够大,几代人几代人的失踪率很可能会导致其消失,而只有少数几代人将在人群中固定。因此,尽管人们认识到,从人类中出现了每一代人的50至100个变种,但这些事件中的大多数在进化过程中都丢失了,这解释了为什么我们的基因组中不存在所有中性替代。另一种观点是基于一个简单的假设,即78亿活着人类中每一个中的50至100从头变体都应该产生与生命兼容的每种核苷酸变化
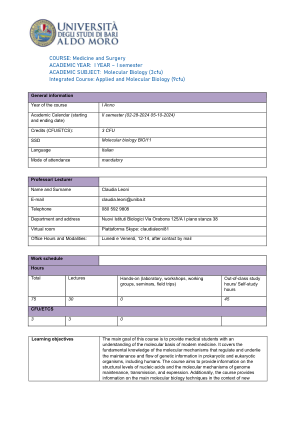
分子生物学(3cfu)综合课程
超螺旋和拓扑性质。拓扑异构酶。细菌类核。组蛋白和核小体的性质和组装。染色质的高级结构。组蛋白的翻译后修饰。溴多胺和染色质结构域。表观遗传学。原核生物和真核生物的基因组。复制模型。DNA合成。细菌DNA聚合酶。校对和缺口翻译。复制子模型。OriC和半甲基化。Ter/Tus。真核细胞核中的复制工厂。ARS结构和复制控制。酶学。前RC和前启动复合物。复制抑制剂,如化疗药物和抗病毒药物。端粒和端粒酶的结构、功能和意义。DNA损伤和修复。基因组作为动态实体。体细胞和种系突变。SNP。内在和外在损伤。化学和物理诱变剂。原核生物和真核生物中的去除、逆转和损伤避免系统。MUT 系统。BER 系统。糖基化酶的重要性。安全系统。NER 系统:UvrABCD 和 XP 蛋白。GG-NER 和 TC-NER。光解作用、MGMT、AlkBH。损伤耐受机制。TLS。细菌中的 SOS 反应。单丝和双丝断裂。HR 和 NHEJ。由于修复系统突变而导致的人类疾病。位点特异性重组。重组酶。Lambda 噬菌体。Cre-Lox 系统和 KO 小鼠。简单和复杂的转座子。SINE 和 LINE 元素、Alu 序列。原核生物和真核生物中的 RNA。结构、类型和特性。细菌 RNA 聚合酶和相关因子。转录单位。转录步骤。细菌启动子中的共识序列。终止机制。抑制剂。 Lac、ara 和 trp 操纵子。阳性和阴性对照。真核细胞中的 RNA 类别。RNA 聚合酶 (CTD) 的结构和功能。三种启动子的特征。基础转录机制。TFIIH。反式激活因子、辅激活因子。CpG 岛甲基化。组蛋白密码。长程调节剂。DNA 结合蛋白的功能域 (HTH、HD、HLH、ZF、LZ)。RNA 成熟、核运输和转录后控制。加帽类型。添加 polyA。CTD 的变化。外显子和内含子。外显子改组。四类内含子及其去除机制。剪接体和剪接位点。AT-AC 剪接。EJC 复合体。可变剪接。ESE 和 ESS 序列、SR 和 hnRNP 蛋白。SMN 基因。剪接和病理。rRNA 和 tRNA 加工反应。核糖体基因。 SnoRNA 和核仁功能。RNA 编辑。插入和转换编辑。人类 RNA 编辑的示例。细胞核和细胞质中的 RNA 周转。外泌体。无义介导的 mRNA 衰变 (NMD)。非编码 RNA。小 RNA 在细胞中的功能。RNA 干扰。siRNA。微小 RNA 的生物发生。miRNA、长链非编码 RNA、环状 RNA 的作用机制。逆转录病毒的一般信息。遗传密码和翻译。遗传密码的性质和特征。线粒体密码。ORF。tRNA 的特征。不常见碱基。aa-tRNA 合成酶的功能和类别。遗传密码的翻译重编码和扩展。SeCys。核糖体是一种核酶。原核生物和真核生物的翻译阶段。不同的启动机制。能量成本。NSMD。细菌中的 tmRNA。抑制剂。蛋白质的翻译后修饰、分选和降解。折叠和错误折叠。朊病毒。HSP60 和 HSP70。泛素和泛素化系统。SUMO 化糖基化。蛋白酶体。肽信号。蛋白质分选。线粒体输入。线粒体基因组细胞中的线粒体可塑性。人类线粒体基因组。遗传、结构、复制及其表达的原理。线粒体 DNA 中的改变。DNA 克隆的原理。修饰限制系统。克隆载体。cDNA 合成。基因组 DNA 和 cDNA 文库。TA 克隆。表达克隆。基因表达沉默。基因治疗。数据库。基因组编辑元件(Talen、Zn 指、CRISPR/Cas9 系统)。PCR 和 DNA 测序。PCR 的特性。PCR-RFLP。实时 PCR、DNA 测序。NGS。核酸杂交。杂交原理。熔点和严格性。探针制备:切口平移。Southern、Northern、杂交测定。蛋白质印迹。