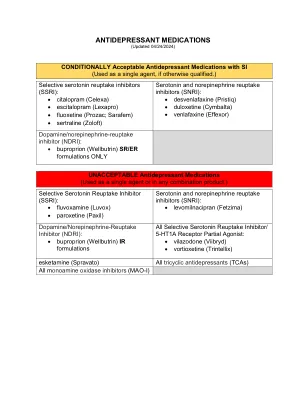
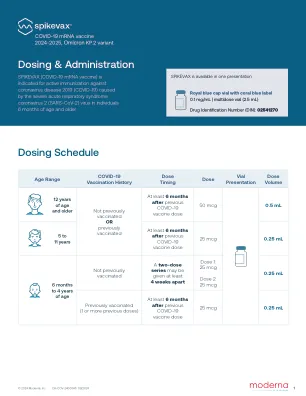
XiaoMi-AI文件搜索系统
World File Search System疫苗给药
我选择了自己和自由地获取Covid-19疫苗。我知道我可以选择拒绝疫苗。我要求将疫苗给我,或向上面提到的人提供此请求。我获得了该疫苗的(疫苗接收者和护理人员的情况说明书)。情况表具有有关副作用和不良反应的信息。我阅读或向我阅读了有关Covid-19疫苗提供的信息。我知道食品药物管理局(FDA)已授权紧急使用该疫苗。我知道这不是完全许可的FDA疫苗。我有机会提出要回答的问题,以满足我的满意。我现在知道疫苗,替代品,福利和风险,在此时已知和未知的程度。我知道我必须在接收免疫接种后留在疫苗区域或医疗保健提供者告诉我的区域,因此,如果我有任何不良反应,我就会靠近我的医疗保健提供者。如果我有严重的过敏反应史(例如,过敏),我必须待30分钟。如果我没有严重的过敏反应史,我必须停留15分钟
电子药
Bhawna Poudyal生物学和电子产品的抽象组合导致了许多新发明。这些对于打击致命疾病很有用。这样的发明是微电子药。这种现象用于检测体内疾病和异常。这是一种不可消化的药丸,由传感器组成。这些传感器测量了各种身体参数,例如胃酸的pH和肠道。有一个控制传感器的集成电路。所有四个传感器中都有。这些测量温度和溶解氧。这些传感器安装在两个硅芯片的顶部。微电子药对身体完全无害。有一个无线电发射机来传感器传输信号。数据将传输到附近的接收器,并将其转换为所需的形式进行分析。排列的顶部有一个化学涂层。本机由AG2O电池提供动力,其工作时间约为35小时。芯片本质上是高度适应性的,可以用于各种生物医学和工业应用中。这些芯片可用于快速检测复杂疾病,否则这些疾病将需要很长时间。使用此术语可以检测到许多胃肠道疾病。在不容易获取样本进行分析的情况下,它特别使用。关键字:微电子,药丸,生物传感器,芯片1。引言我们熟悉电子领域中广泛的传感器。顾名思义,该传感器是一种药丸。2。它们也广泛用于各种实验和研究活动中。这种微电代药是具有许多通道的传感器,被称为多通道传感器。那就是要进入体内并研究内部条件。早些时候是在发明晶体管时,首先使用辐射胶囊。这些胶囊利用简单的电路来研究胃肠道。阻止其使用的某些原因是它们的大小和不超过单个通道的传输限制。他们的可靠性和敏感性差。传感器的寿命也太短。这为实施单个通道遥测胶囊铺平了道路,后来开发了它们以克服大尺寸实验室类型传感器的缺点。半导体技术也有助于形成,因此最终开发了当前看到的微电药。这些药现在用于在研究和诊断中进行远程生物医学测量。传感器利用微技术来实现目的。使用该药丸的主要目的是进行内部研究,并识别或检测胃肠道中的异常和疾病。在此GI(胃肠道)中,我们不能在访问受到限制时使用旧的内窥镜。可以通过这些药丸来测量许多参数,其中包括电导率,pH温度和胃肠道中溶解的氧气量。微电代药,微电子药的设计是胶囊的形式。它具有的包裹是生物相容性的。内部是多通道(四个通道)传感器和一个对照芯片。它还包括无线电发射机和两个银氧化物细胞。四个传感器安装在两个硅芯片上。除此之外,还有一个控制芯片,一个访问通道和一个无线电发射机。通常使用的四个传感器是温度传感器,pH ISFET传感器,双电极电极传感器和三个电极电化学传感器。在这些温度传感器中,pH ISFET传感器和双电极电极传感器在第一个芯片上制造。三个电极电化学细胞氧传感器将在芯片2上。第二芯片还由可选的NICR电阻温度计组成。
帕博利珠单抗单药治疗造成皮肤损伤后,减少...
摘要 ━━ 背景。肉瘤样癌是一种罕见的肺癌类型,一般认为对化疗和放疗具有耐药性。病例。一名 68 岁男性在 2022 年 10 月的一次体检中,在一次简单的胸部 X 光检查中被诊断出异常;随后,他在 2022 年 11 月就诊当地医生,同时出现右侧胸痛。胸部计算机断层扫描 (CT) 显示右下叶结节和胸腔积液,正电子发射断层扫描 (PET) 显示结节和胸膜内有氟脱氧葡萄糖积聚。患者被转诊至我院进行进一步检查和治疗。随后,他于 2022 年 12 月通过 CT 引导活检被诊断为肉瘤样癌。由于程序性细胞死亡配体 1 (PD-L1) 表达水平高,于 2023 年 1 月开始使用派姆单抗;结果,原发肿瘤缩小,胸腔积液减少。随后,出现皮肤反应,2 个周期后停用派姆单抗,但肿瘤大小保持不变。结论。众所周知,在某些非小细胞肺癌病例中,即使在发生免疫相关不良事件后停止治疗后,反应仍会维持。在本例中,在肺肉瘤样癌中观察到了类似的过程。 (JJLC. 2024;64:923-928)关键词 ━━ 肺肉瘤样癌、免疫检查点抑制剂、程序性细胞死亡配体 1 (PD-L1)、帕博利珠单抗
Zanubrutinib单药治疗,用于治疗幼稚的慢性淋巴细胞性白血病和17p缺失
,其肿瘤的缺失17p13.1 [del(17p)]的预后不佳,对标准化学化学免疫疗法的反应较差。Zanubrutinib是一种选择性的下一代Bruton酪氨酸激酶抑制剂。我们评估了Zanubruti-Nib 160 mg的安全性和功效,每天两次在未接受的DEL(17p)疾病的患者中,该患者参加了III III SECOIA试验的专用,非随机组(ARM C)。总共招募了109例患者(中位年龄,70岁;范围为42-86),并招募了中央确认的DEL(17p)。中位数为18.2个月(范围为5.0–26.3)后,有7名患者因进行性疾病而停止研究治疗,四例由于不良事件而导致的研究,另一项是由于撤回同意而导致的。总体反应率为94.5%,有3.7%的患者在有或没有不完全血液恢复的情况下获得完全反应。估计的18个月无进展生存率为88.6%(95%CI:79.0–94.0),估计的18个月总生存率为95.1%(95%CI:88.4-98.0)。最常见的全级不良事件包括挫伤(20.2%),上呼吸道感染(19.3%),新肌肉/中性粒细胞计数降低(17.4%)和腹泻(16.5%)。≥3级不良事件发生在53例患者(48.6%),最常见的是神经肌(12.9%)和肺炎(3.7%)。报告了三名患者(2.8%)的房颤发生不良事件。该试验被注册为临床。Zanubrutinib具有活性,并且在此前未经治疗的DEL(17p)慢性淋巴细胞性白血病/小型淋巴细胞淋巴瘤的大型,前瞻性地招募的治疗队列中均具有良好的影响。