XiaoMi-AI文件搜索系统
World File Search System多种内分泌肿瘤2型2中有什么新功能?
ret(转染后重新排列)原癌基因在1985年被发现为癌基因。1 RET癌基因位于染色体10(10q.11.2)上的编码酪氨酸激酶家族的受体,这对于神经系统的发展以及源自神经crest的器官和组织的发展很重要。3种RET形式中的每一个都由3个不同的转录本编码。3个成绩单都有ER EXON 19;但是,随着外显子19的3'端的可变剪接,它们形成未剪接的外显子19,外显子20和外显子21。RET同工型具有9(RET9),51(RET51)和43(RET43)氨基酸C末端末端,由这些转录本编码。体内主要同工型为ret9和ret51,分别由1072和1114氨基酸组成。尽管在大多数组织中共表达,但这两种同工型具有不同的发育作用和基因表达谱,这意味着在细胞细胞接触途径调节中可能存在差异。2,3
激素受体和HER2作为乳腺癌的前瞻性分子标记的作用:更新
摘要本综述提供了有关当前方法,原理和作用机理,用于检测乳腺癌进展和复发预后的治疗性能分子标志物,包括雌激素受体(ER),孕激素受体(PR)和人类胚芽生长因子受体2(HERS 2)。的确,激素受体,即ER,PR,原癌基因HER2是基本的分子标记物,用于治疗实践,被识别和确定的预后因素和反应的预测指标。可以通过使用免疫疗法化学(IHC)和原位杂交(FISH)来检测这些标记,这些(FISH)是建立,更快且具有成本效益的检测方法的。这些分子标志物以及临床病理预后参数可以最好地预测癌症复发和进展的预后。最后,作为分子标记物的激素受体和HER2具有主要的治疗意义,并且有能力参与未来的药物开发技术。版权所有ª2020年,重庆医科大学。Elsevier B.V.这是CC BY-NC-ND许可证(http://creativecommons.org/licenses/by-nc-nd/4.0/)下的开放访问文章。
使用儿童脑肿瘤分子分层的临床试验
刺猬因子 (SHH) 激活和肿瘤抑制蛋白 p53 (TP53) 突变、SHH 激活和 TP53 野生型以及非 WNT/非 SHH(第 3 组和第 4 组)],其中第 3 组 MB 在所有亚组中预后最差,TP53 突变状态是 SHH 激活 MB 中最重要的风险因素 (4-6)。同样,儿童低级别胶质瘤 (PLGG) 在 BRAF 基因 (B-Raf 原癌基因或 v-Raf 鼠肉瘤病毒癌基因同源物 B1) 中存在不同的异常,这提供了有关肿瘤表型以及患者总体生存的信息 (7,8)。此外,儿童高级别胶质瘤 (PHGG) 患者的预后因编码组蛋白变体 H3.3 (H3F3A) 和 H3.1 (HIST1H3B) 的基因突变而不同 (9)。鉴于这些分子差异的临床意义,最近的临床试验旨在确定驱动突变和其他生物标志物,以便进行靶向治疗。本综述介绍了最近的文献,并重点介绍了利用
非小细胞肺癌靶向治疗检测 AHS - M2030
非小细胞肺癌 (NSCLC) 是一组异质性癌症,包括除小细胞肺癌 (SCLC) 之外的任何类型的上皮性肺癌,小细胞肺癌起源于肺的上皮细胞,包括鳞状细胞癌、大细胞癌和腺癌 (Thomas, et al., 2023)。最近,NSCLC 中的致癌作用与表皮生长因子受体 (EGFR) 的突变或间变性淋巴瘤激酶 (ALK) 基因或 ROS1 基因的重排有关 (Sequist & Neal, 2024)。有关在 NSCLC 中使用循环肿瘤细胞的指导,请参阅政策 AHS-G2054 液体活检。有关肿瘤突变负荷测试 (TMB) 和/或微卫星不稳定性 (MSI) 分析的指导,请参阅 AHS-M2178 微卫星不稳定性与肿瘤突变负荷测试政策。相关政策:AHS-G2054 液体活检 AHS-M2029 皮肤黑色素瘤分子检测 AHS-M2078 RET 原癌基因种系突变基因检测 AHS-M2160 肺部疾病分子检测 AHS-M2178 微卫星不稳定性与肿瘤突变负荷测试
1064 科学文摘
结果:共获得2670个DEGs和371个TSPJ靶点,其中重叠基因52个,41个基因存在蛋白相互作用,可用于构建PPI网络。KEGG富集分析结果包括VEGF和HIF-1信号通路。对VEGF和HIF-1信号通路中DEGs的相关性分析,获得7个负相关基因和16个正相关基因。SRC原癌基因、非受体酪氨酸激酶(SRC)和信号转导和转录激活因子3(STAT 3)在PPI中具有较高的程度值,并且在通路中表现出显著相关性,被视为重点靶点。与CIA模型组相比,TSPJ显著降低了AI和组织学评分。此外,血清或脾脏中 VEGF-A、HIF-1 α、IL-1 β 和 IL-17A 的表达呈剂量依赖性显著降低。结论:本研究表明,SRC 和 STAT 3 可能是 TSPJ 作用于 VEGF 和 HIF-1 信号通路的关键靶点,从而抑制血管生成并改善 RA。利益披露:未声明 DOI:10.1136/annrheumdis-2021-eular.3496
RET 相关肿瘤的精准肿瘤学
RET 原癌基因的异常激活与多种癌症有关。RET 获得功能点突变是多发性内分泌肿瘤 2 (MEN2) 综合征和散发性髓样甲状腺癌的驱动事件,而 RET 重排是多种非髓样甲状腺癌的驱动事件。能够抑制 RET 的药物已用于治疗 RET 突变癌症。最初使用的是多激酶抑制剂,尽管它们显示出适度的疗效和显著的毒性。然而,新的 RET 选择性抑制剂,如 selpercatinib 和 pralsetinib,最近已经过测试,并显示出良好的疗效和耐受性,即使目前还没有多激酶和选择性抑制剂之间的直接比较。高通量技术的出现已识别出除点突变和融合之外的罕见 RET 变异(包括 RET 缺失)的癌症,这引发了人们对这些变异是否具有功能性影响以及是否可以被 RET 抑制剂靶向的问题。在这篇小型综述中,我们重点关注具有 RET 缺失(包括缺失/插入 (indel))的肿瘤及其对 RET 抑制剂的反应。
BRAF 抑制剂在转移性结直肠癌中的应用及其耐药机制:文献综述
结直肠癌是目前最常见的肿瘤之一,是男性第三大常见肿瘤,女性第二大常见肿瘤 [1]。其在西方国家的发病率呈上升趋势,高达 70% 的 CRC 为散发性肿瘤,且与烟草、酒精、饮食、久坐的生活方式或肥胖等环境因素有关 [2]。全球范围内,结直肠癌占全球所有新发癌症病例的 11% [3],其中高达四分之一在诊断时已出现远处转移。在其余四分之三可进行手术的患者中,近一半会在疾病过程中出现转移 [2]。因此,这带来了重大的医疗保健挑战。BRAF 原癌基因位于 7 号染色体上,由 18 个外显子组成 [2]。7% 的肿瘤存在该基因突变,其中大部分是黑色素瘤,其中高达 50% 的肿瘤存在 BRAF 突变 [4]。在转移性结直肠癌中,BRAF 突变频率徘徊在 12% 左右 [ 5 ]。转移性结直肠癌中的 BRAF 突变具有独立的预后价值,并与临床和生物学疾病特征有显著关联 [ 6 ]。这导致人们对 BRAF 突变的基因检测和针对它们的靶向治疗的开发越来越感兴趣。
局部晚期炎症性肌纤维细胞肿瘤接受了靶向疗法:病例报告和文献综述
炎症性肌纤维细胞肿瘤(IMT)已知与变性淋巴瘤激酶(ALK)基因重排有关。在IMT中也发现了其他分子改变,例如ROS原癌基因1,受体酪氨酸激酶(ROS1),神经营养酪氨酸受体激酶(NTRK)和血小板衍生的生长因子受体(PDGFR)。尽管没有比较化学疗法,酪氨酸激酶抑制剂(TKI)或其他全身疗法的随机对照临床试验,但文献证明了使用ALK靶向的TKI作为治疗局部晚期或转移性ALK-REARK-RERANK-RERANK-RERANK-RERANGED IMTS的有效策略。本病例报告描述了一名患有ALK重态的局部晚期肺IMT的患者,该患者接受了新辅助治疗的crizotinib治疗。患者对治疗的反应非常有利,手术被拒绝。很难确定在这些设置中使用TKI使用的持续时间和测序,因为很少有数据可以指导决策。本报告还包括对已发表的IMT病例进行的全面汇编,该病例已通过全身疗法治疗分子改变,这也强调了疗法和临床结果的持续时间。
卡马替尼治疗晚期非小细胞肺癌
Capmatinib (INC280, TABRECTA) 是一种口服生物可利用的原癌基因 cMet(肝细胞生长因子受体 [HGFR])抑制剂,具有潜在的抗肿瘤活性。Capmatinib 是一种针对 c-Met 的小分子激酶抑制剂,c-Met 是一种受体酪氨酸激酶,在健康人体内,它可激活参与器官再生和组织修复的信号级联。已知异常的 c-Met 激活(通过突变、扩增和/或过度表达)发生在多种类型的癌症中,并导致多个下游信号通路过度激活。2 Capmatinib 选择性地与 c-Met 结合,从而抑制 c-Met 磷酸化并破坏 c-Met 信号转导通路。这可能会诱导过度表达 c-Met 蛋白或表达组成性激活 c-Met 蛋白的肿瘤细胞死亡。 c-Met 是一种受体酪氨酸激酶,在许多肿瘤细胞类型中过度表达或突变,在肿瘤细胞增殖、存活、侵袭、转移和肿瘤血管生成中起关键作用。3 在 II 期临床试验(Geometry Mono-1,NCT02414139)中,卡马替尼以每天两次 400 毫克的剂量口服给药。1
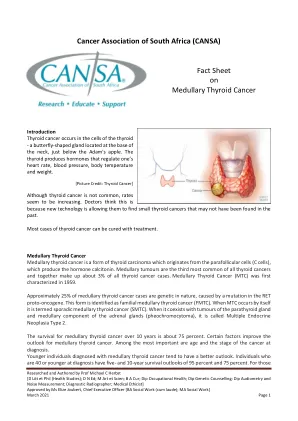
在甲状腺 - 甲状腺癌 -
[图片来源:甲状腺癌]尽管甲状腺癌并不常见,但率似乎在增加。医生认为这是因为新技术允许他们找到过去可能没有发现的小甲状腺癌。大多数甲状腺癌病例可以通过治疗治愈。甲状腺癌甲状腺甲状腺癌是甲状腺癌的一种形式,起源于产生激素降钙素的副细胞(C细胞)。髓质肿瘤是所有甲状腺癌中第三大最常见的肿瘤,共同占所有甲状腺癌病例的3%。甲状腺癌(MTC)首次在1959年进行表征。大约25%的甲状腺癌病例本质上是遗传性的,是由Ret原癌基因突变引起的。这种形式被确定为家族性甲状腺癌(FMTC)。当MTC本身发生时,它被称为零星甲状腺癌(SMTC)。当它与肾上腺的甲状旁腺的肿瘤和髓质成分并存时,它称为多种内分泌肿瘤2型。甲状腺癌在10年内的生存率约为75%。某些因素改善了甲状腺癌的前景。最重要的是诊断时的年龄和癌症的阶段。诊断为甲状腺癌的年轻人往往具有更好的前景。诊断40岁以下的个人的生存前景为95%和75%。对于那些