XiaoMi-AI文件搜索系统
World File Search System使用剪接切换反义寡核苷酸的视网膜炎色素炎11的精确治疗方法,以恢复PRPF31的开放阅读框架
摘要:色素性视网膜炎11是一种不可治疗的,主要遗传的视网膜疾病,由MRNA加工因子31 PRPF31中的杂合突变引起。PRPF31的表达水平与受影响家庭的不完全渗透有关;具有较高PRPF31表达的突变载体可以无症状。当前的研究探讨了反义寡核苷酸外显子跳过策略,以治疗由PRPF31外显子12中截断突变引起的RP11,因为它似乎没有编码PRPF31蛋白质功能所必需的任何域。细胞源自携带PRPF31 1205C>的患者,研究了废话突变。由1205C> A编码的PRPF31转录本由于胡说八道介导的mRNA衰变而无法检测到,相对于健康的供体细胞,PRPF31 mRNA降低了46%。反义寡核苷酸诱导的外显子12的跳过,拯救了开放式阅读框,因此在RP11患者成纤维细胞中,prpf31 mRNA上调为1.7倍。PRPF31上调的水平达到了具有相同突变的非探针载体家族成员推断出的预测的表达阈值。这项研究表明,诱导PRPF31同工型的PRPF31表达和核易位能力的保留增加。未来的研究应评估诱导的PRPF31蛋白在视网膜细胞中MRNA剪接上的功能,以验证可依延RP11引起的突变的治疗方法。
有理药物发展中的反义和功能性核酸
摘要:本综述集中于反义和功能性核酸,用于完全合理的药物设计和药物靶标评估,旨在减少时间和金钱,并增加成功的药物开发率。核酸具有独特的特性,可以在药物发育中作为药物靶标和药物发挥两个重要作用。药物靶标可以是信使,核糖体,非编码RNA,核酶,核糖开关和其他RNA。此外,各种反义和功能性核酸可能是药物发现中的宝贵工具。在亲核和工程方法中基于RNA的基因表达控制基因表达的许多机制开放了具有关键作用的药物发现的新途径。本综述讨论了在药物输送和设计中反义和功能性核酸的设计原理,应用和前景。这种核酸包括反义寡核苷酸,合成核酶和siRNA,可用于有效的有效抗菌药物开发。反义和功能性核酸的重要特征是使用有理设计方法进行药物开发。本评论旨在普及这些新颖的方法,以使制药业和患者受益。
GalNAc3 结合反义药物与相同序列 2′-O-甲氧乙基修饰反义药物的安全性和耐受性比较:来自 1 期临床试验数据综合评估的结果
三天线 N-乙酰半乳糖胺 (GalNAc 3 ) 簇已证明受体介导的配体结合反义药物摄取的效用,这些药物靶向肝细胞表达的 RNA。GalNAc 3 结合的 2 ¢ - O - 甲氧乙基 (2 ¢ MOE) 修饰的反义寡核苷酸 (ASO) 已证明比未结合形式具有更高的效力,以支持较低剂量获得相同的药理作用。我们利用 Ionis 集成安全数据库比较了四种 GalNAc 3 结合和四种相同序列未结合的 2 ¢ MOE ASO。该评估评估了来自八项随机安慰剂对照剂量范围 1 期研究的数据,涉及 195 名健康志愿者(79 名 GalNAc 3 ASO,24 名安慰剂;71 名 ASO,21 名安慰剂)。两组 ASO 临床实验室测试中未发现异常阈值发生率的安全性信号。但是,与安慰剂相比,未结合 2 ¢ MOE ASO 组高剂量范围内的平均丙氨酸转氨酶水平显著升高。与未结合 ASO 组相比,GalNAc 3 -结合 ASO 组导致局部皮肤反应的皮下注射平均百分比低 30 倍(0.9% vs. 28.6%),未发生流感样反应(0.0% vs. 0.7%)。未结合 ASO 组中的三名受试者(4.2%)停止服药。在健康志愿者的短期临床数据比较中,GalNAc 3 -结合 2 ¢ MOE ASO 的整体安全性和耐受性特征明显改善。
双重靶向CRISPR-CASRX在体外和体内降低了C9orf72 ALS/FTD感官和反义重复RNA
额颞痴呆(FTD)和肌萎缩性侧索硬化症(ALS)的最常见遗传原因是G 4 C 2重复扩展在C9orf72基因的内含子中。这种重复的扩展经历了双向转录,产生了感觉和反义重复的RNA物种。在所有阅读帧中,有义务和反义的重复RNA都经历重复相关的非AUG翻译,以生成五种不同的二肽重复蛋白(DPRS)。重要的是,毒性与感官和反义重复衍生的RNA和DPR既相关。这表明针对感官和反义重复RNA可能会提供最有效的治疗策略。涉及RNA的CRISPR-CAS13系统为同时定位多个RNA转录本的途径提供了有希望的途径,因为它们成熟了自己的引导阵列,因此可以从单个构造中靶向一个以上的RNA物种。我们表明,源自Ruminococcus flavefaciens(CASRX)的CRISPR-CAS13D可以成功地将C9orf72 sense和反义重复记录和DPR降低到过度表达C9orf72重复的HEK细胞中的背景水平。CRISPR-CASRX还显着降低了三种独立的C9ORF72患者衍生的IPSC-神经元系中的内源性和反义重复RNA和DPR,而没有可检测到的脱靶效应。为了确定CRISPR-CASRX在体内是否有效,我们使用AAV递送处理了两种不同的C9orf72重复小鼠模型,并观察到在有意义和反义重复的转录本上都显着降低。这项工作共同介绍了将RNA靶向CRISPR系统作为C9ORF72 ALS/FTD的治疗方法的潜力。
对反义 RNA 功能和机制的最新见解:在癌症治疗和精准医学中的新兴应用
反义 RNA 分子是一种独特的 DNA 转录本,由 19 – 23 个核苷酸组成,其特点是与 mRNA 具有互补性。这些反义 RNA 在调节基因表达的各个阶段(包括复制、转录和翻译)中起着至关重要的作用。此外,人工反义 RNA 已证明其能够有效调节宿主细胞中的基因表达。因此,致力于研究反义 RNA 作用的研究大幅增加。这些分子被发现对各种细胞过程有影响,例如 X 染色体失活和健康细胞中的印迹沉默。然而,重要的是要认识到,在癌细胞中,异常表达的反义 RNA 可以触发肿瘤抑制基因的表观遗传沉默。此外,缺失诱导的异常反义RNA的存在可以通过表观遗传沉默导致疾病的发展。值得一提的一个药物开发领域是反义寡核苷酸(ASO),致癌反式长链非编码RNA(lncRNA)的一个主要例子是HOTAIR(HOX转录本反义RNA)。NAT(非编码反义转录本)在许多癌症中失调,研究人员才刚刚开始揭示它们作为癌症特征的关键调节器的作用,以及它们在癌症治疗中的潜力。在这篇综述中,我们总结了反义RNA的新兴作用和机制,并探讨了它们在癌症治疗中的应用。
反义寡核苷酸:药理学策略的新前沿
反义寡核苷酸 (ASO) 是短的单链合成 RNA 或 DNA 分子,而双链 RNA 核苷酸序列称为小干扰 RNA (siRNA)。ASO 与互补核酸序列结合,影响靶核酸的相关功能。它们代表了一类新兴药物,通过革命性的作用机制,旨在直接调节致病基因及其变体,为传统的“蛋白质特异性”疗法提供替代工具。大多数 ASO 旨在治疗孤儿遗传疾病,在大多数情况下,这些疾病会严重致残,并且仍然缺乏适当的治疗方法。为了将 ASO 转化为临床成功,不断的技术进步有助于克服多种药理学、毒理学和配方限制。因此,最近已经实施了化学结构,并探索了新的生物共轭和纳米载体配方策略。这项工作的目的是提供反义技术的概述,并对美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 批准的寡核苷酸进行比较分析。
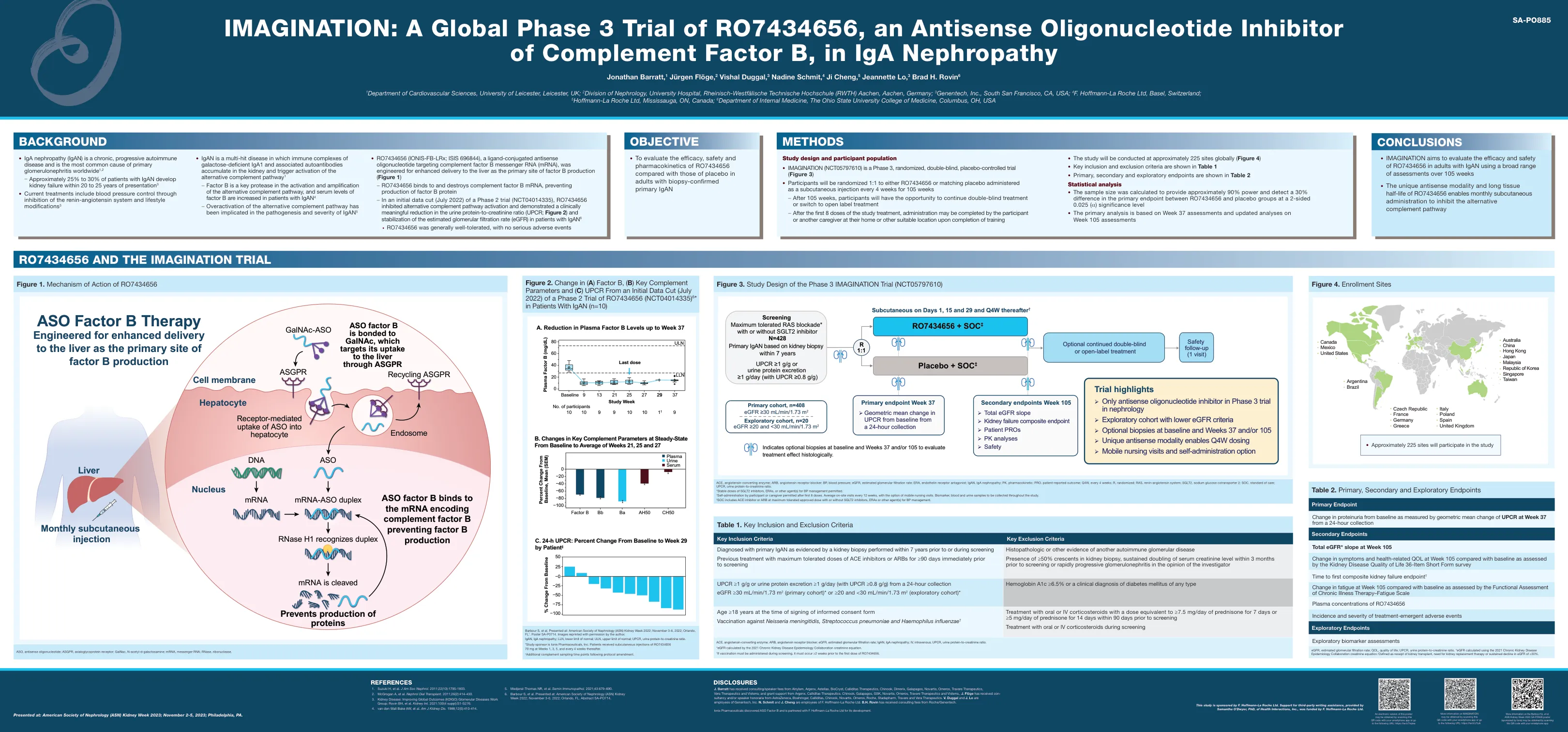
想象力:Iga肾病中的RO7434656的全球3期试验,RO7434656,一种反义寡核苷酸抑制剂B的反义寡核苷酸抑制剂
j。巴拉特(Barratt)从Alnylam,Arganx,Asterelas,Biocryst,Calliditas Therapeutics,Chinok,Chinok,Chinok,Dimerix,Dimerix,Galapagos,Veras,Veraros,Veraros,Vera Therapeutics,Vera Therapeutics,Vera Therapeutics and Observer获得了咨询/发言人FES;并毕业于Argaanx,Calliditas Therapeutics,Chinook,Galapagos,GSK,Omerus,Travere Therapeutics和Visterras。奇努克人,诺华,奥梅鲁斯,罗氏,斯塔达姆,特拉维尔和维拉治疗学。V. Duggaal和J.lo Aree雇员N. Schmit和J. Cheng是F. Hoffmann-La Roche Ltd. B.H.
反义RNA(ASRNA)技术:作物改善和可持续农业中的概念和应用
保质期,木质素含量的减少,营养品质的增强,细菌和病毒耐药性,改变的花色等。(Le and Wang 2011; Tiwari等人2014)。尽管其他形式的反义技术(例如RNAi,siRNA和miRNA)已被广泛用于修饰和改善农作物的各种目的,但使用asrna的使用正在获得更多的接受度(Xu等人 2018; Tilahun等。 2021; Sinha等。 2023)。 因此,使用反义RNA技术改善了高经济和文化意义的农作物(表1),而在最近的十年中,更多的农作物是更多的关注和研究兴趣,这是针对反义RNA在作物改善中的应用。 此外,小型非编码RNA已被用作一种生物学工具,以在没有特定方式的特定方式中在体外和体内和调节基因中研究基因功能2018; Tilahun等。2021; Sinha等。2023)。因此,使用反义RNA技术改善了高经济和文化意义的农作物(表1),而在最近的十年中,更多的农作物是更多的关注和研究兴趣,这是针对反义RNA在作物改善中的应用。此外,小型非编码RNA已被用作一种生物学工具,以在没有特定方式的特定方式中在体外和体内和调节基因中研究基因功能
反义寡核苷酸的治疗术治疗骨关节炎:机会和障碍
骨关节炎(OA)是一种使人衰弱的疾病,没有批准的疾病改良疗法。在开发治疗的challenges中正在实现针对受影响关节的靶向药物。这导致了几个候选药物治疗OA的失败。在过去20年中,在反义寡核苷酸(ASO)技术中取得了重大进展,以实现在体外和体内靶向递送到组织和细胞的靶向递送。由于ASO能够结合特定的基因区域并调节蛋白质翻译,因此它们可用于纠正与某些疾病相关的异常内源机制。ASO可以通过关节内注射在本地传递,并可以通过天然的细胞摄取机制进入细胞。尽管如此,ASO尚未在OA治疗的临床试验中成功测试。最近对ASO的化学方法进一步改善了细胞摄取和降低的毒性。是基于锁定的核酸(LNA)的ASO,在肝炎和血脂异常等疾病的临床试验中显示出令人鼓舞的结果。最近,基于LNA的ASO在体外和体内都经过了OA的治疗性测试,并且有些在临床前OA动物模型中显示出有希望的联合保护作用。为了加速OA临床试验环境中ASO疗法的测试,需要进一步研究递送机制。在本评论文章中,我们讨论了目前正在临床前测试中的病毒,粒子,生物材料和化学修饰的疗法的机会。我们还解决了基于ASO的OA治疗疗法的临床翻译中的潜在障碍,例如与OA动物模型相关的局限性以及药物毒性的挑战。总的来说,我们回顾了已知的内容以及加速基于ASO的OA治疗疗法的翻译。
传染病的反义疗法
摘要:传染病,尤其是由结核分枝杆菌引起的结核病 (TB),对全球健康构成了重大挑战,2021 年报告的死亡人数为 160 万人,是单一传染源导致的最致命疾病。耐药性传染病的增加增加了寻找有效和安全的干预疗法的紧迫性。反义疗法使用反义寡核苷酸 (ASO),它们是与其 mRNA 靶标互补的短的、化学修饰的单链脱氧核糖核苷酸分子。由于其设计的靶标特异性和在 mRNA 水平上抑制致病基因,反义疗法作为一种潜在的治疗方法引起了人们的兴趣。这种类型的疗法目前用于多种疾病,例如癌症和遗传疾病。目前,关于使用 ASO 治疗传染病的研究有限,但正在稳步增加。本综述探讨了 FDA 批准和临床前测试的 ASO 作为传染病治疗的可持续性,以及 ASO 对化学修饰的适应性,从而减少副作用并改善药物输送;从而强调了 ASO 在治疗传染病方面的潜在治疗用途。