XiaoMi-AI文件搜索系统
World File Search System唾液酸 - 化学系
神经氨酰酸 ( 1 ) 结构中存在的多种功能团使得其化学结构相对容易修改。所获得的衍生物在与神经氨酸酶(负责唾液酸水解的酶)相互作用的程度和方式以及病毒进入细胞的渗透性方面有所不同。下面介绍了一些修饰 Neu5Ac ( 3 ) 化学结构的方法:C-1 位酰胺化( 6 - 神经氨酸酶抑制剂)、C-3 位氟化( 7 - 神经氨酸酶抑制剂)、C-4 和 C-9 位叠氮化( 8 和 10 - 与大配体结合的便捷底物)、C-5 位脱乙酰胺( 9 - 合成酰胺衍生物的底物)、C-2 位脱水( 12 )以及 C-7 和 C-8 处羟基的醚化( 11 - 潜在的神经氨酸酶抑制剂)[3]。
两亲性唾液酸衍生物作为潜在的双重...- lirias
1杜布雷森大学药物化学系,匈牙利H-4032 DEBRECEN; elorincz01@gmail.com(E.B.L.); herczeg.mihaly@pharm.unideb.hu(M.H.); borbas.aniko@pharm.unideb.hu(A.B。); herczegh.pal@pharm.unideb.hu(p.h.)2迪克雷大学药学博士学校,H-4032 DEBRECEN,匈牙利3国家生物分子研究中心,Masaryk University,611 37 Brno,捷克共和国Brno; josef.houser@ceitec.cz(J.H.); lenka.malinovska@ceitec.muni.cz(L.M.); michaw@chemi.muni.cz(M.W。)4中欧理工学院,马萨里克大学,捷克共和国625 00 BRNO 5 BRNO 5 BRNO,MASARYK University科学系生物化学系,捷克共和国Brno 611 37; rievajova.martina@mail.muni.cz 6应用化学系,杜布雷森大学H-4032 DEBRECEN,匈牙利DEBRECEN; kuki.akos@science.unideb.hu 7 Rega医学研究所,Ku Leuven,B-3000 Leuven,Belgium; lieve.naesens@kuleuven.be 8 National Laboratory of Virology, University of P é cs, H-7624 P é cs, Hungary 9 HUN-REN–UD Molecular Recognition and Interaction Research Group, University of Debrecen, H-4032 Debrecen, Hungary * Correspondence: bereczki.ilona@pharm.unideb.hu
利用内皮唾液酸蛋白 (...) 针对活化的微环境
摘要 背景 由于缺乏合适的肿瘤特异性抗原,以及免疫抑制和促纤维化肿瘤微环境阻碍了 CAR-T 细胞的浸润、活性和持久性,嵌合抗原受体 (CAR)-T 细胞靶向实体癌的应用受到限制。我们假设,靶向由肿瘤相关周细胞和血管周围癌症相关成纤维细胞强烈表达的内皮唾液酸蛋白 (CD248) 受体将避免这些挑战,并为 CAR-T 细胞疗法提供令人兴奋的抗原,因为靶细胞与肿瘤血管距离很近,正常组织中内皮唾液酸蛋白表达有限,并且内皮唾液酸蛋白敲除小鼠缺乏表型。方法我们从三种免疫活性小鼠品系 BALB/c、FVB/N 和 C57BL/6 中生成了内皮唾液酸蛋白靶向的 E3K CAR-T 细胞。评估了 E3K CAR-T 细胞组成(CD4 + / CD8 + 比例)、体外对内皮唾液酸 + 和内皮唾液酸 – 细胞的活性,以及在同源肿瘤模型以及未接受肿瘤治疗的健康和受伤小鼠和携带肿瘤的内皮唾液酸基因敲除小鼠中的体内扩增和活性。结果 E3K CAR-T 细胞在体外对小鼠和人类内皮唾液酸 + 细胞均有活性,但对内皮唾液酸 – 细胞无活性。过继转移的 E3K CAR-T 细胞在内皮唾液酸基因敲除小鼠、未接受肿瘤治疗的内皮唾液酸野生型小鼠或伤口愈合模型中均无活性,表明不存在脱靶和在靶/脱肿瘤活性。相比之下,将 E3K CAR-T 细胞过继转移到携带同基因乳腺癌或肺癌系的 BALB/c、FVB/N 或 C57BL/6 小鼠体内,会耗尽肿瘤基质中的靶细胞,导致肿瘤坏死增加、肿瘤生长减缓和转移性生长显著受损。结论这些数据共同强调了内皮唾液酸蛋白是 CAR-T 细胞疗法的可行抗原,并且靶向与肿瘤血管密切相关的基质细胞可避免 CAR-T 细胞不得不在严酷的免疫抑制肿瘤微环境中生存。此外,E3K CAR-T 细胞识别和靶向小鼠和人内皮唾液酸蛋白 + 细胞的能力使人性化和优化的 E3K CAR 成为适用于多种实体瘤类型临床开发的有希望的候选药物。
唾液酸:靶向癌症进展,转移和对治疗的抗性的途径
糖蛋白和细胞表面上的糖脂。唾液酸通过与碳水化合物和蛋白质相互作用,在细胞之间进行通信,并充当病毒和细菌的细胞表面受体,在多种生理和病理过程中起作用。几项研究表明,由于其糖基化状态的变化,唾液酸在癌细胞上的异常模式。这种模式可能归因于肿瘤细胞中发生的各种生理和病理变化。在肿瘤中的高血压,其参与肿瘤生长,免疫逃避和摆脱凋亡途径,转移形成和治疗耐药性的逃脱都得到了很好的研究。方法:进行了PubMed搜索,并在2000年至2020年的不同研究中发表了文章,并进行了审查。在这里,我们讨论
唾液酸o-乙酰化:从生物合成到E.A.健康和疾病Visser的角色;卫星,S.J。; Timmermans,S.B.P.E。; Jong,H。de; Boltje,T.J。
唾液酸是九种碳糖,经常在脊椎动物细胞中的细胞表面以及某些类型的无脊椎动物和细菌的细胞中限制胶囊。唾液酸的九个碳主链可以在自然界中进行广泛的酶促修饰,并在C-4/7/8/9处尤其是在C-4/7/8/9处进行O-乙酰化。近年来,o-乙酰化的唾液酸的检测和分析已经采用了乳酸特异性(SOATS)和O-乙酰基酯酶(SIAES),分别鉴定并在哺乳动物细胞中添加和表征盐酸 - 乙酰基酯酶(SOATS)和O-乙酰酯酶(SIAES)(SIAES)(SIAES)(SIAES)(SIAES)(siaES),分别鉴定出和去除O-乙酰基组。这些进步现在使我们能够更完整地了解多样的O-乙酰化唾液酸的生物合成途径,以驱动遗传和生物化学模型细胞系和生物体的产生,并具有o-乙酰化的唾液酸表达的表达,以改变其角色,以使其在孔隙蛋白中脱离孔隙蛋白的良好性,并伴随着孔隙蛋白的良好性,并具有良好的发现,并具有良好的发现,并具有良好的发现,并具有良好的发现,并逐渐识别。此外,越来越多的研究将唾液酸O-乙酰化与癌症,自身免疫性和感染相关联,这为开发选择性探针和Soats and Siaes的抑制剂提供了理由。在这里,我们讨论了O-乙酰化唾液酸的生物合成和生物学功能的当前见解,并回顾了将这种修饰与疾病联系起来的证据。此外,我们讨论了针对不自然的O-乙酰化唾液酸的设计,合成和潜在应用的新兴策略,以及肥皂和SIAES的抑制剂,这些策略可能可以实现这种多功能唾液酸的治疗靶向。
唾液酸官能化的金纳米颗粒,用于敏感和选择性比色测定5-羟色胺
摘要:我们提出了一种受自然复杂机制启发的新型比色方法,能够选择性地确定具有高灵敏度的5-羟色胺。此方法利用了链接到金纳米颗粒(SA-Aunps)的唾液酸(SA)分子的固有结合亲和力。在5-羟色胺结合,sa-aunps骨料和Sa-unps吸光度的特征性红移后,也会发生剧烈的色彩变化(红色至蓝色),即使没有仪器也很容易观察到。提出的方法有效地消除了潜在干扰物种(例如多巴胺,肾上腺素,L-酪氨酸,葡萄糖胺,半乳糖,甘露糖和草酸)的干预措施。缺乏与5-羟色胺相关的与结构相关的前体L- tryptophan的变化,进一步证实了这种方法检测方法的高选择性。比色法具有宽的线性动态范围(0.05 - 1.0μm),检测的低极限(0.02μm)和快速响应时间(5分钟)。该方法的检测极限低于到目前为止报道的其他比色性羟色胺传感器。通过在处理后血浆中采用5-羟色胺回收测定法评估了所提出的方法在生物样品分析中的使用。回收率为90.5%至104.2%,显示出有希望的临床应用潜力。
衰老神经生物学
唾液酸结合免疫球蛋白样凝集素 (Siglec) 受体与神经退行性过程有关,但唾液酸在生理性衰老中的作用仍未完全了解。我们研究了唾液酸生物合成所必需的葡萄糖胺-2-表异构酶/N-乙酰甘露糖胺激酶 (GNE + / ) 杂合子小鼠脑内唾液酸化降低的影响。我们证明 GNE + / 小鼠在 6 个月时不同脑区已出现唾液酸化降低、海马体突触减少、小胶质细胞树突状化减少,随后 12 个月时神经元丢失增加。转录组分析显示未发现促炎症变化,这表明在衰老过程中 GNE + / 小鼠的突触和神经元被固有的稳态免疫过程所清除。与补体 C3 缺乏的小鼠杂交挽救了早期发生的神经元和突触丢失以及小胶质细胞树突状化的变化。因此,糖萼的唾液酸有助于大脑稳态,并充当大脑先天免疫系统的识别系统。2020 作者。由 Elsevier Inc. 出版。这是一篇根据 CC BY-NC-ND 许可协议开放获取的文章(http://creativecommons.org/licenses/by-nc-nd/4.0/)。
在神经退行性和精神疾病中靶向溶解和siglec的治疗潜力
唾液酸通常在哺乳动物细胞的糖脂中被发现为末端碳水化合物,是先天免疫系统的关键检查点抑制剂,尤其是中枢神经系统(CNS)。在小胶质细胞上表达的唾液酸结合型免疫球蛋白样凝集素(Siglecs)是通过识别完整的溶解酶来维持小胶质细胞稳态的关键参与者。精细平衡的唾液酸 - siglec系统可确保预防中枢神经系统中过度和有害的免疫反应。然而,溶解和SIGLEC受体功能障碍的丧失导致多种慢性中枢神经系统疾病。SIGLEC3 / CD33,SIGLEC11和SIGLEC14的遗传变异与神经退行性疾病(如阿尔茨海默氏病)有关,而siAllylltransferase ST8SIA2和SigleC4 / MAG已将精神疾病与精神病患者相关,例如Schizizoplenia,Biporlial and biporlial and biporal and biporal and siglec4 / mag。因此,在阿尔茨海默氏病动物模型和炎症引起的CNS组织损伤中,多氨酸和SIGLEC结合抗体的免疫调节功能已被实验剥削。虽然这些治疗方法的潜力显而易见,但在患者临床试验中,仅测试了靶向乙二醇或SIGLEC受体的几种疗法。在这里,我们概述了唾液酸 - siglec轴在神经变性和突触病的背景下塑造小胶质细胞激活和功能中所起的关键作用,并讨论靶向溶解溶性或siglecs的当前疗法的景观。
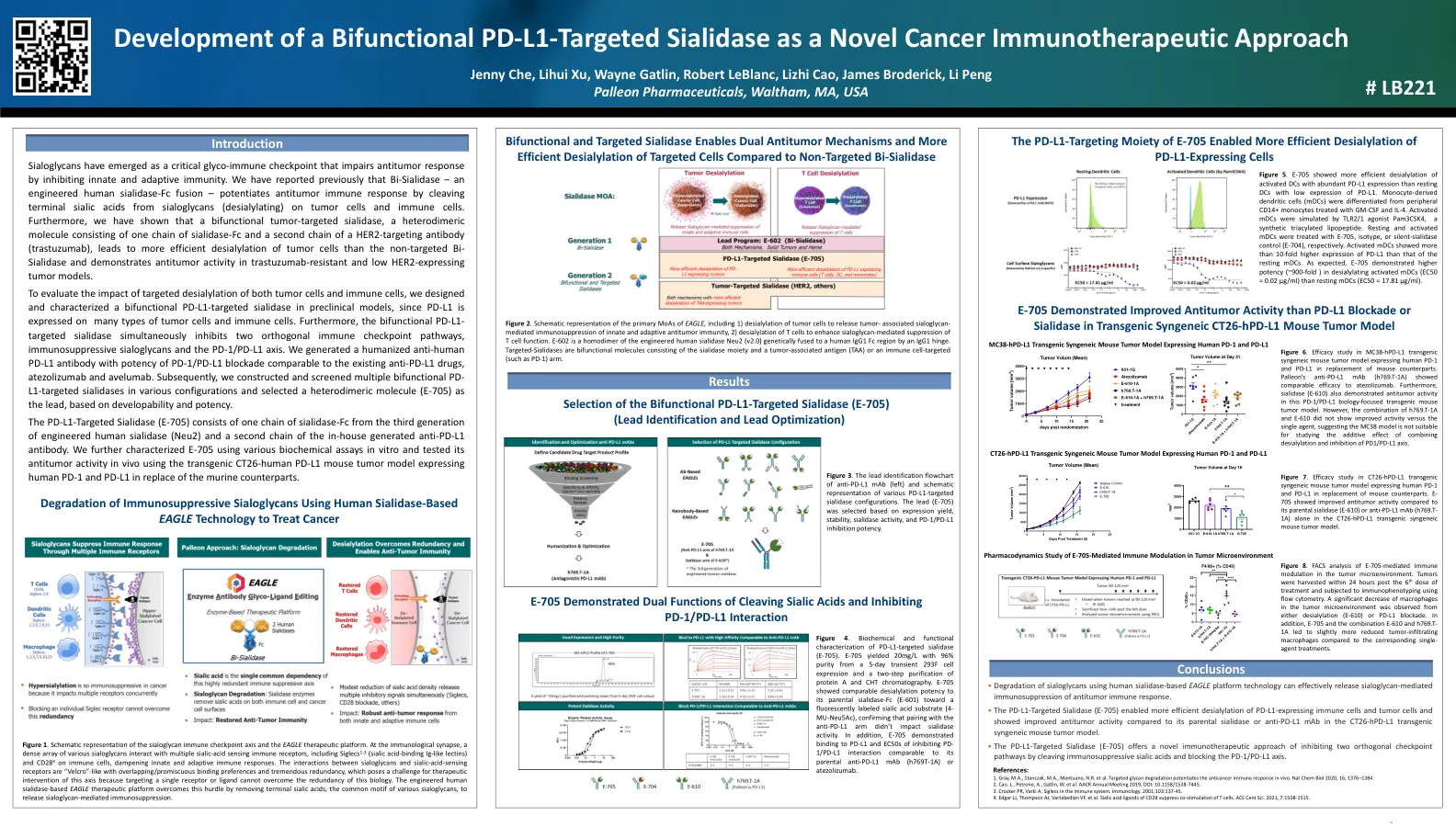
开发双功能 PD-L1 靶向唾液酸酶作为新型癌症免疫治疗方法
为了评估靶向脱唾液酸对肿瘤细胞和免疫细胞的影响,我们在临床前模型中设计并表征了一种双功能 PD-L1 靶向唾液酸酶,因为 PD-L1 在多种类型的肿瘤细胞和免疫细胞上表达。此外,双功能 PD-L1 靶向唾液酸酶同时抑制两种正交免疫检查点通路、免疫抑制唾液酸聚糖和 PD-1/PD-L1 轴。我们生成了一种人源化抗人 PD-L1 抗体,其 PD-1/PD-L1 阻断效力可与现有的抗 PD-L1 药物阿替利珠单抗和阿维鲁单抗相媲美。随后,我们构建并筛选了多种不同配置的双功能 PD-L1 靶向唾液酸酶,并根据可开发性和效力选择了一种异二聚体分子 (E-705) 作为先导。