XiaoMi-AI文件搜索系统
World File Search System基于U-NET的模型,用于最佳MR脑图像分割
摘要:MRIS的脑肿瘤分割一直是放射科医生的一项艰巨任务,因此,需要自动和广义的系统来解决此任务。在医学成像中使用的所有其他深度学习技术中,基于U-NET的变体是文献中最常用的模型,可针对不同的方式分割医学图像。因此,本文的目的是研究U-NET体系结构中的众多进步和创新,以及最近的趋势,目的是强调使用U-NET的持续潜力用于改善脑肿瘤分割的性能。此外,我们还提供了不同U-NET体系结构的定量比较,以从优化的角度突出该网络的性能和演变。除此之外,我们还尝试了四个U-NET体系结构(3D U-NET,COATION U-NET,R2 COATION U-NET和修改3D U-NET),用于Brats 2020数据集,以供脑肿瘤细分,以更好地概述该体系结构在DICE SCORE和HAUSDORFF距离上的概述。最后,我们分析了医学图像分析的局限性和挑战,以提供有关在优化方面开发新体系结构的重要性的批判性讨论。
使用生物医学图像分割的变异推断的不确定性定量
由卷积神经网络激励的深度学习在一系列医学成像问题(例如图像分类,图像分割,图像合成等)中非常成功。但是,对于验证和可解释性,我们不仅需要模型做出的预测,而且还需要在做出这些预测时它的自信。这对于人民接受安全的关键应用很重要。在这项工作中,我们使用了基于变异推理技术的编码器解码器结构来分割脑肿瘤图像。我们使用骰子相似性系数(DSC)和联合(IOU)的交集作为评估指标,评估公开可用的Brats数据集的工作。我们的模型能够以原则上的贝叶斯方式考虑脑肿瘤,同时考虑到疾病的不确定性和认知不确定性。
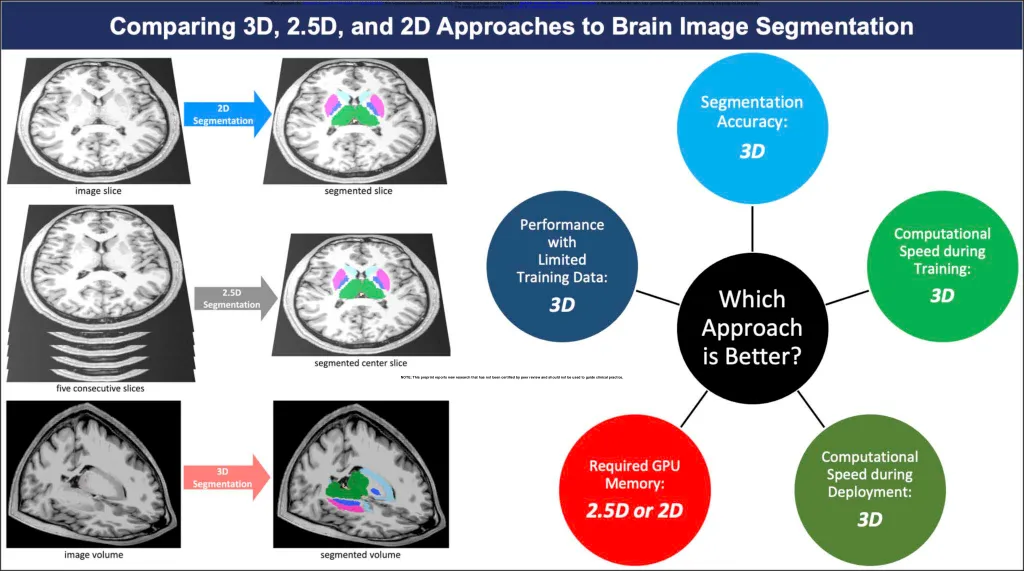
比较 3D、2.5D 和 2D 脑图像分割方法
摘要 用于自动分割脑部图像的深度学习方法可以分割图像的一片(2D)、五片连续的图像切片(2.5D)或整个图像体积(3D)。目前尚不清楚哪种方法更适合自动分割脑部图像。我们在三个自动分割模型(胶囊网络、UNets 和 nnUNets)中比较了这三种方法(3D、2.5D 和 2D)来分割脑部结构。我们使用在一项多机构研究中获得的 3430 个脑部 MRI 来训练和测试我们的模型。我们使用了以下性能指标:分割准确性、有限训练数据下的性能、所需的计算内存以及训练和部署期间的计算速度。3D、2.5D 和 2D 方法在所有模型中分别给出了最高到最低的 Dice 分数。当训练集大小从 3199 个 MRI 减少到 60 个 MRI 时,3D 模型保持了更高的 Dice 分数。 3D 模型在训练期间的收敛速度提高了 20% 至 40%,在部署期间的收敛速度提高了 30% 至 50%。但是,与 2.5D 或 2D 模型相比,3D 模型需要 20 倍以上的计算内存。这项研究表明,3D 模型更准确,在有限的训练数据下保持更好的性能,并且训练和部署速度更快。但是,与 2.5D 或 2D 模型相比,3D 模型需要更多的计算内存。
增强了脑肿瘤MR图像分割的增强区域
摘要:脑肿瘤是儿童和成人死亡率增加的最大原因之一。脑肿瘤是大量的组织,它无法控制调节大脑内部生长的正常力。脑肿瘤就会出现。大脑内部或颅骨内部的细胞异常生长,可能是癌变或非癌性的是成年人在埃塞俄比亚等发展中国家之下的成年人死亡的原因。研究表明,生长算法的区域可以手动或半手动初始化种子点,从而影响分割结果。但是,在本文中,我们提出了一种增强的自动种子点初始化区域生长算法。使用常见数据集Brats2015将拟议方法的性能与最先进的深度学习算法进行了比较。在拟议的方法中,我们应用了阈值技术来从每个输入脑图像中剥离头骨。剥去头骨后,将大脑图像分为8个块。然后,对于每个块,我们计算了平均强度,并从中从八个块中选择了最大平均强度的五个块。接下来,将五个最大平均强度用作分别生长算法的区域的种子点,并为每个头骨剥离的输入脑图像获得了五个不同的感兴趣区域(ROI)。我们提出的方法在三种不同的实验设置中得到了验证。使用骰子相似性评分(DSS),联合(IOU)的交叉点以及针对地面真实(GT)的准确性(GT)评估了使用拟议方法生成的五个ROI,并选择了最佳的感兴趣区域作为最佳ROI。最后,将最终的ROI与DSS的不同最新深度学习算法和基于区域的分割算法进行了比较。在第一个实验设置中,其中15个随机选择的大脑图像用于测试,并实现了DSS值为0.89。在第二和第三实验设置中,提出的方法分别为12个随机选择和800个脑图像的DSS值分别为0.90和0.80。三个实验设置的平均DSS值为0.86。
基于双向RNN的3D医疗图像分割的少数射击学习
在3D医学图像中对感兴趣的器官进行分割是准确诊断和纵向研究的必要条件。尽管使用深度学习的最新进展已显示出许多细分任务的成功,但是高性能需要大的数据集,而注释过程既耗时又耗时。在本文中,我们提出了一个3D少数射击分割框架,以使用目标器官注释的有限训练样本进行准确的器官序列。为了实现这一目标,像U-NET一样的网络旨在通过了解支持数据的2D片与查询图像之间的关系,包括辅助门控复发单元(GRU),该单元(GRU)了解相邻切片之间编码特征的一致性。此外,我们会介绍一种传输学习方法,以通过在支持数据中采样的任意支持和查询数据进行测试之前对模型进行更新,以适应目标图像和器官的特征。我们使用带有不同器官注释的三个3D CT数据集评估了我们提出的模型。我们的模型比最先进的射击分段模型产生了显着提高的性能,并且与经过更多目标培训数据训练的完全监督模型相当。
像医学居民一样培训:对通用医学图像分割的上下文学习
临床成像工作流的主要重点是疾病诊断和管理,导致医学成像数据集与特定的临床目标密切相关。这种情况导致了开发特定于任务的分割模型的主要实践,而没有从广泛的成像群中获得见解。受到医学放射学居民培训计划的启发,我们提出了向普遍医学图像分割的转变,旨在通过利用临床目标,身体区域和成像方式的多样性和共同点来建立医学图像理解基础模型的范式。div of这个目标,我们开发了爱马仕,一种新颖的上下文 - 学习方法,以应对医学图像segmentation中数据杂基的挑战和注释差异。在五种模式(CT,PET,T1,T2和Cine MRI)和多个身体区域的大量各种数据集(2,438个3D图像)中,我们证明了通用范式比传统范式在单个模型中解决多个任务的传统范式的优点。通过跨任务的协同作用,爱马仕在所有测试数据集中都能达到最先进的性能,并显示出卓越的模型可伸缩性。其他两个数据集中的结果揭示了爱马仕在转移学习,分裂学习和对下游任务的概括方面的出色表现。爱马仕(Hermes)博学的先生展示了一个具有吸引力的特征,以反映任务和方式之间的复杂关系,这与既定的放射学解剖学和成像原则相吻合。代码可用1。
基于改进UNet网络的磁共振成像脑肿瘤图像分割方法
5倍交叉验证评估结果(1,2)表明,由于电离辐射和基因突变的影响,胶质瘤占中枢神经系统原发性肿瘤的27%(3-6)。胶质瘤的发病率随年龄增长而增加(1,2,6-8),不同级别的胶质瘤发病率不同。根据恶性程度,胶质瘤病理分为I至IV级,其中II级及以下为低级别胶质瘤(LGG),III级及以上为高级别胶质瘤(HGG)(9)。例如,HGG患者的中位生存期(MST)通常小于2年,而患有HGG的HGG患者的MST仅为4至9个月。此外,分子研究已发现了可增强诊断和提供生物标志物的特征(10)。异柠檬酸脱氢酶 1 和 2 (IDH1/2) 突变以及 X 编码蛋白 (ATRX) 和 TP53 突变的存在提示弥漫性星形细胞瘤,而 IDH1/2 突变与 1p19q 缺失相结合则提示少突胶质细胞瘤 (10)。受体酪氨酸激酶基因的局部扩增、端粒酶逆转录酶 (TERT) 启动子突变以及 10 号和 13 号染色体的缺失和 7 号染色体的三体性是胶质母细胞瘤的显著特征,可用于诊断目的 (10)。此外,LGG 中 B-Raf 原癌基因 (BRAF) 基因融合和突变的存在以及 HGG 中组蛋白 H3 的突变的存在也可以作为
使用深度神经网络进行医学图像分割的综合研究
摘要 — 在过去十年中,使用深度神经网络 (DNN) 的医学图像分割 (MIS) 取得了显着的性能改进,并具有巨大的发展前景。本文对基于 DNN 的 MIS 进行了全面的研究。智能视觉系统通常根据其输出级别进行评估,例如数据、信息、知识、智能和智慧 (DIKIW),而这些级别的 MIS 中最先进的解决方案是研究的重点。此外,可解释人工智能 (XAI) 已成为一个重要的研究方向,因为它旨在揭示以前 DNN 架构的“黑匣子”性质,以满足透明度和道德要求。该研究强调了 MIS 在疾病诊断和早期检测中的重要性,特别是通过及时诊断来提高癌症患者的存活率。XAI 和早期预测被认为是从“智能”到“智慧”之旅的两个重要步骤。此外,本文还解决了现有挑战并提出了潜在的解决方案,以提高实施基于 DNN 的 MIS 的效率。
低光3D医疗图像分割的替代基线--- Atlas Perspective
低射击(一次/几次)分割引起了越来越多的注意力,因为它在有限的注释方面效果很好。状态低射击分割方法通常集中于每个新颖类的隐式表示学习,例如学习原型,通过掩盖的平均池来得出指导特征,以及使用特征空间中的余弦相似性进行分割。我们认为,医学图像上的低射击序列应进一步,以明确了解图像之间的密集对应关系以利用解剖学相似性。核心思想的灵感来自多ATLAS分割的策略实践,其中基于地图集的分割的不可分割部分,即,注册,标签繁殖和标签融合均未验证为我们的工作中的一个框架。特别是,我们提出了两个替代基本线,即暹罗基线和个体差异意识到的基线,其中前者针对的是解剖上稳定的结构(例如脑组织),而后者则具有强大的普遍化能力,可以进行大量的大型形态学变异(例如大型形态学或 - ab domalminal ab domalminal(例如abansminal)。总而言之,这项工作为低射击3D医疗图像分割建立了基准,并阐明了对基于ATLAS的几片分段的理解。
AM-SegNet 用于增材制造原位 X 射线图像分割和特征量化
摘要 同步加速器 X 射线成像已用于检测金属增材制造 (AM) 过程中熔池的动态行为,此过程中会产生大量图像数据。在此,我们开发了一种高效且稳健的深度学习模型 AM-SegNet,用于分割和量化高分辨率 X 射线图像,并准备了一个包含超过 10,000 个像素标记图像的大型数据库,用于模型训练和测试。AM-SegNet 结合了一个轻量级卷积块和一个定制的注意机制,能够以高精度(∼ 96%)和处理速度(每帧 < 4 毫秒)执行语义分割。分割结果可用于关键特征(例如锁孔和孔隙)的量化和多模态相关分析。此外,还展示了 AM-SegNet 在其他先进制造工艺中的应用。所提出的方法将使制造和成像领域的最终用户能够加速从收集到分析的数据处理过程,并提供对过程控制物理学的洞察。