XiaoMi-AI文件搜索系统
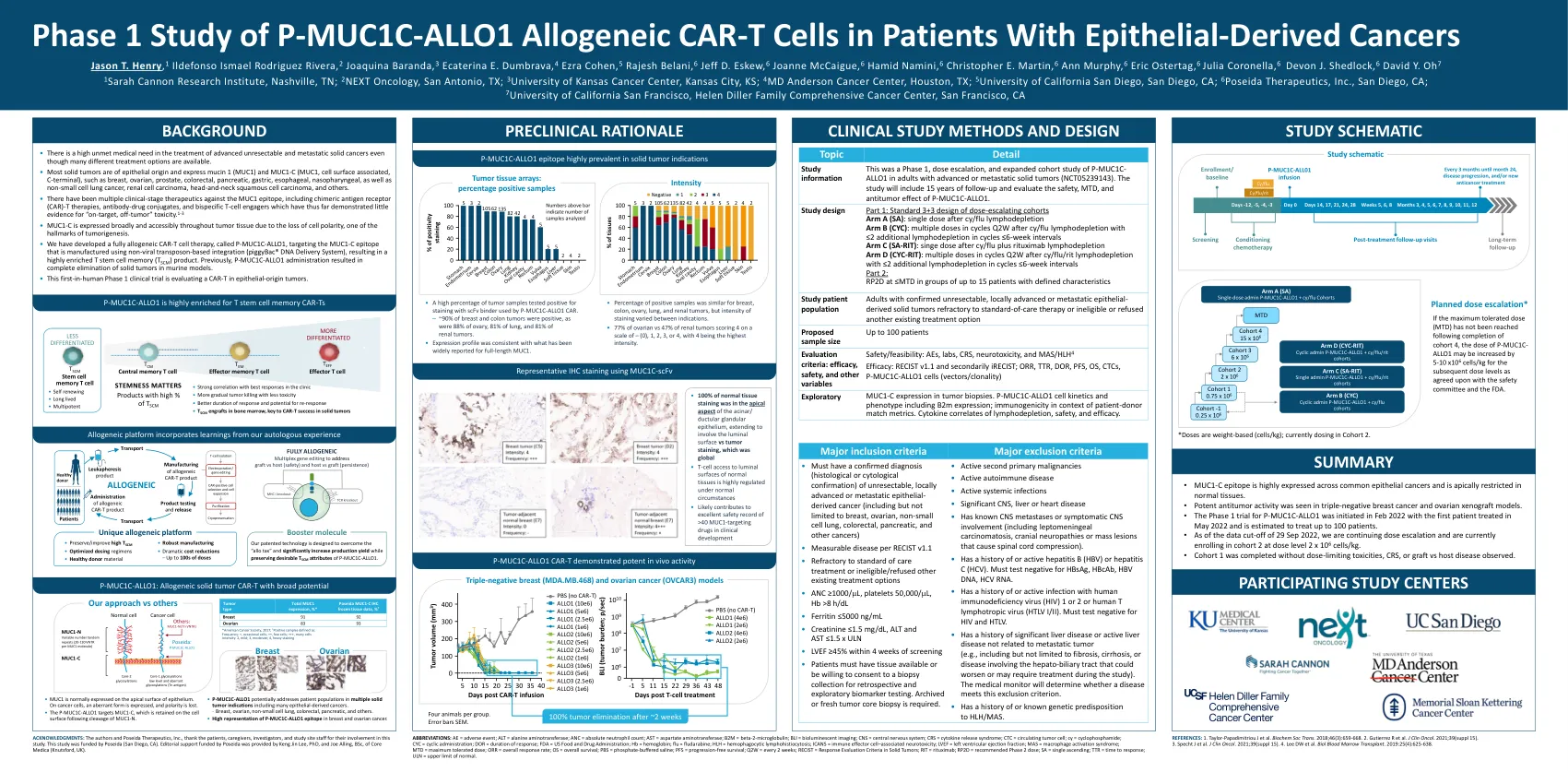
World File Search SystemP-MUC1C-ALLO1 同种异体 CAR-T 细胞治疗上皮源性癌症患者的 1 期研究
缩写:AE = 不良事件;ALT = 丙氨酸氨基转移酶;ANC = 绝对中性粒细胞计数;AST = 天冬氨酸氨基转移酶;B2M = β-2-微球蛋白;BLI = 生物发光成像;CNS = 中枢神经系统;CRS = 细胞因子释放综合征;CTC = 循环肿瘤细胞;cy = 环磷酰胺;CYC = 周期性给药;DOR = 缓解持续时间;FDA = 美国食品药品管理局;Hb = 血红蛋白;flu = 氟达拉滨;HLH = 噬血细胞性淋巴组织细胞增生症;ICANS = 免疫效应细胞相关神经毒性;LVEF = 左心室射血分数;MAS = 巨噬细胞活化综合征;MTD = 最大耐受剂量;ORR = 总有效率;OS = 总生存期;PBS = 磷酸盐缓冲盐水;PFS = 无进展生存期;Q2W = 每 2 周RECIST = 实体瘤疗效评价标准;RIT = 利妥昔单抗;RP2D = 推荐的 2 期剂量;SA = 单次升序;TTR = 缓解时间;ULN = 正常上限。
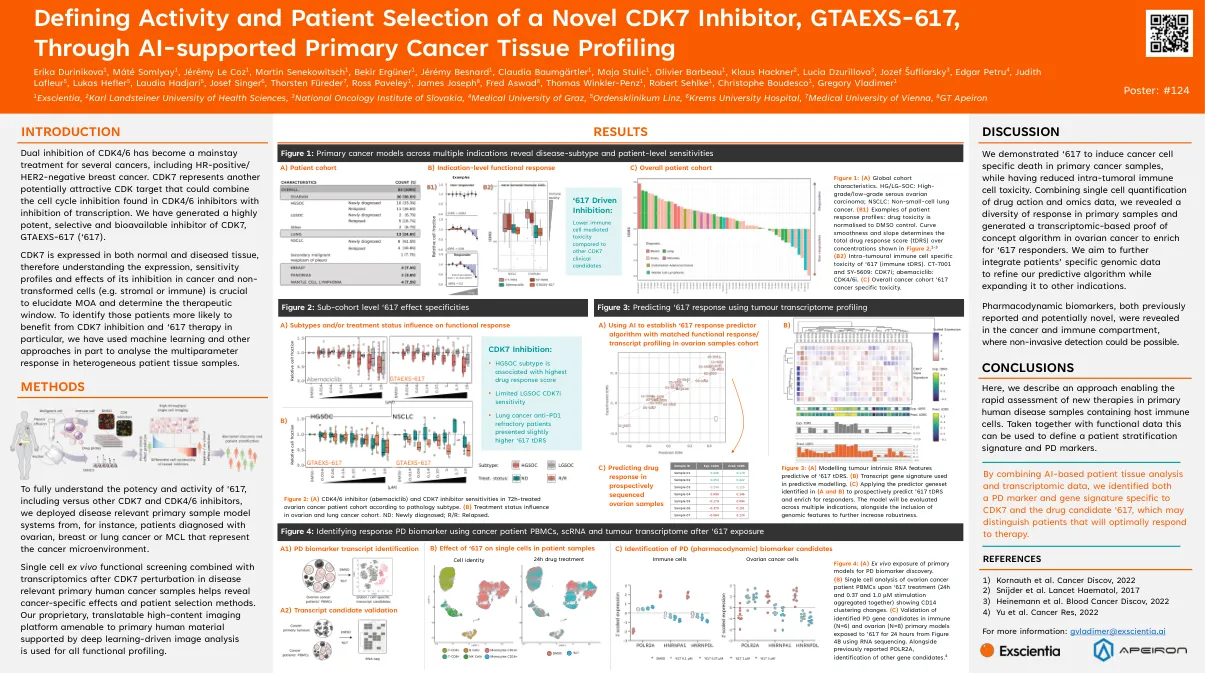
通过AI支持的原发性癌组织分析定义新型CDK7抑制剂GTAEXS-617的活性和患者选择
图1:(a)全局队列特征。HG/LG-SOC:高级/低级浆液卵巢癌; NSCLC:非小细胞肺癌。(B1)患者反应曲线的例子:药物毒性归一化为DMSO控制。曲线平滑度和斜率决定了图2所示的浓度的总药物反应评分(TDR)。1-3(b2)umoune免疫细胞特异性毒性为‘617(免疫TDR)。CT-7001和SY-5609:CDK7I; Abemaciclib:CDK4/6i。(c)总体癌症队列'617癌症特异性毒性。
蛋白质冠状降低了氧化石墨烯在 HER-2 阳性癌细胞中的抗癌作用
纳米系统以不可预测的方式发挥作用。例如,据观察,只有 0.7% 的纳米系统剂量到达目标组织,因为生物纳米相互作用可能会扰乱其主要功能并影响细胞识别和摄取。6 随着纳米材料在生物医学中的应用日益广泛,考虑到人类接触纳米疗法和治疗的增加,这方面正成为优先事项。特别是在癌症治疗领域,随着市场上可用产品数量的增加,基于纳米颗粒的抗癌疗法的商业化正在大幅增加。 7 这些包括聚合物载体 8,9 (例如,水凝胶、聚合物囊泡、树枝状聚合物和纳米纤维),脂质载体 10 - 12 (例如,脂质体、固体脂质纳米颗粒和胶束),金属纳米颗粒 13 (例如,金、银和钛),碳结构(例如,纳米管、纳米角、纳米金刚石)和石墨烯。14,15 然而,只有不到 10% 的此类纳米治疗剂能够转化为临床应用,其余大部分是有希望的但临床上无效的实验性疗法。16 这使得转化研究成为一项长期而昂贵的事业,
通过整合体外药物反应试验和药物蛋白质分析推断肿瘤特异性癌症依赖性
发现肿瘤特异性分子依赖性可能会改善癌症疗法的开发。必需的工具包括遗传和化学扰动,每种方法都有其优点和局限性。化学扰动可以很容易地大规模应用于原发性癌症样本,但由于一种化合物对多种蛋白质具有亲和力,因此对命中的机制理解和进一步的药物开发通常很复杂。为了从体外药物敏感性曲线计算推断出单个癌症的特定分子依赖性,我们开发了一个数学模型,使用蛋白质-药物亲和力曲线的测量值对这些数据进行解卷积。通过整合药物激酶分析数据集和几种药物反应数据集,我们的方法 DepInfeR 正确识别了已知的蛋白激酶依赖性,包括 HER2+ 乳腺癌细胞系的 EGFR 依赖性、具有 FLT3 -ITD 突变的急性髓细胞白血病 (AML) 的 FLT3 依赖性以及两种主要慢性淋巴细胞白血病 (CLL) 亚型对 B 细胞受体途径的差异依赖性。此外,我们的方法发现了新的亚组特定依赖性,包括以前未报告的高危 CLL 对检查点激酶 1 (CHEK1) 的依赖性。该方法还生成了 117 个 CLL 样本异构集中激酶依赖性的详细图谱。将多药理学表型反卷积为潜在的因果分子依赖性的能力应该会增加高通量药物反应检测在功能精准肿瘤学中的效用。
guardant360-cdx-适用于局部晚期或转移性癌症患者...
液体活检的肿瘤基因分型消除了组织活检的局限性,并将精准肿瘤学扩展到之前因组织取样障碍而不符合条件的患者。11 与组织活检相比,液体活检的侵入性较小,只需要少量血液样本。与手术活检相比,这降低了患者的手术风险和样本采集成本。此外,液体活检克服了组织活检的空间限制,可以进行连续检测以评估癌症进展,从而更好地指导治疗决策。17 然而,应该注意的是,液体活检可能受到全身肿瘤负担低、胸外转移扩散低或脑等庇护部位受累导致 ctDNA 脱落率低的限制。16 此外,液体活检不提供有关组织学亚型和组织学变化的信息。因此,在某些情况下,液体活检可以替代组织检测,而在其他情况下,组织检测仍然是首选。无论如何,液体活检和组织检测的结果可能是互补的。
抗雄激素疗法放射治疗可增强雄激素受体阳性癌症对 18F-FDG 的敏感性
一部分(35%)三阴性乳腺癌 (TNBC) 表达雄激素受体 (AR) 活性。然而,抗雄激素药物的临床试验显示其疗效有限,临床受益率约为 19%。我们研究了抗雄激素与 18 F-FDG 联合作为放射增敏剂对 TNBC 的治疗增强作用。方法:我们筛选了 5 种候选药物,以评估与 18 F-FDG、X 射线或紫外线照射联合使用时(剂量低于其各自的半最大抑制浓度)的共同毒性。使用细胞增殖和 DNA 损伤测定来评估抗雄激素与 18 F-FDG 联合使用的细胞毒性增强作用。最后,在小鼠 TNBC 和前列腺癌肿瘤模型中评估了联合治疗的治疗效果。结果:发现抗雄激素药物比卡鲁胺与 18 F-FDG 或 X 射线联合使用时具有相似的毒性,表明其作为 18 F-FDG 放射增敏剂的敏感性。细胞增殖试验表明,与 AR 阴性 PC3 细胞相比,比卡鲁胺与 18 F-FDG 联合使用对 AR 阳性 22RV1 和 MDA-MB-231 细胞具有选择性毒性。定量 DNA 损伤和细胞周期停滞试验进一步证实了辐射对细胞的损伤,表明比卡鲁胺作为 18 F-FDG 介导的辐射损伤的放射增敏剂的作用。在 MDA-MB-231、22RV1 和 PC3 小鼠肿瘤模型中进行的动物研究表明,与 AR 阴性模型相比,AR 阳性模型中通过结合使用比卡鲁胺和 18 F-FDG 可以显著抑制肿瘤生长。组织病理学检查证实了体外和体内数据,并证实了对重要器官没有脱靶毒性。结论:这些数据证明 18 F-FDG 与抗雄激素联合用作放射增敏剂可作为放射治疗剂用于消融 AR 阳性癌症。
贝伐单抗和鲁卡帕里的II期试验在子宫颈或子宫内膜的复发性癌中
目标。这项研究的目的是检查复发性宫颈癌或子宫内膜癌患者的贝伐单抗鲁卡巴氏疗法的耐受性和效率。患者和方法。33例复发性宫颈癌或子宫内膜癌的患者被招募。首先治疗转移性或复发性疾病后,患者必须在肿瘤进展。rucaparib每天两次以600毫克的竞标给予rucaparib。bevacizumab在每个21天周期的第1天以15 mg/kg的速度给予。主要终点是效率,由客观响应率或6个月的无进展生存期确定。结果。在33名患者中,可评估28名患者。子宫内膜癌患者的缓解率为17%,而宫颈癌患者的缓解率为14%。中值无进展生存期为3.8个月(95%C·I 2.5至5.7个月),中位总生存期为10.1个月(95%C·I 7.0至15.1个月)。ARID1A突变患者的反应率(33%)和6个月的无进展生存率(PFS6)率(67%)比整个研究人群。观察到的毒性类似于先前对贝伐单抗和鲁卡巴里的研究。结论。在所有复发性宫颈癌或子宫内膜癌患者中,贝伐单抗与鲁卡巴氏的结合并未显示出明显增加的抗肿瘤活性。然而,ARID1A突变患者的缓解率较高,PFS6表明该亚组可能会从贝伐单抗和鲁卡帕里的组合中受益。需要进一步的研究来确认这一观察结果。没有看到新的安全信号。©2022 Elsevier Inc.保留所有权利。
头颈部腺样囊性癌的外科治疗以外的治疗:文献综述
简介:腺样囊性癌 (AdCC) 是一种罕见肿瘤,约占所有唾液腺肿瘤的 10%。它发生在所有年龄组中,女性占多数,但迄今为止尚未发现任何风险因素。尽管 AdCC 表现为生长缓慢的肿瘤,但其特点是多次和晚期复发。因此,我们旨在更新晚期和复发病例的治疗方案知识。材料和方法:我们进行了系统的文献综述,以综合 AdCC 非手术治疗所需的实践知识。总共从 1208 篇可用出版物中选择了 99 篇进行分析。结果:AdCC 被描述为由上皮细胞和肌上皮细胞组成的基底样肿瘤。免疫组织化学可用于诊断(PS100、波形蛋白、CD117、CKit、肌肉肌动蛋白、p63)和预后(Ki67)。已识别的突变可能带来治疗机会(MYB-NFIB、Notch 1)。检查主要基于颈部和胸部 CT 扫描和 MRI,可以考虑使用 18-FDG 或 PSMA 进行 PET-CT。对于可切除病例,手术治疗仍然是金标准。术后调强放疗是标准治疗方法,但在特定情况下可以使用强子疗法。根据现有文献,无法推荐标准化疗方案。结论:目前尚无关于 AdCC 化疗使用的共识,无论是术后同时进行放疗还是转移阶段。此外,可用的靶向疗法尚未提供显着的肿瘤反应。关键词:腺样囊性癌、唾液腺、头颈部肿瘤、流行病学、治疗学
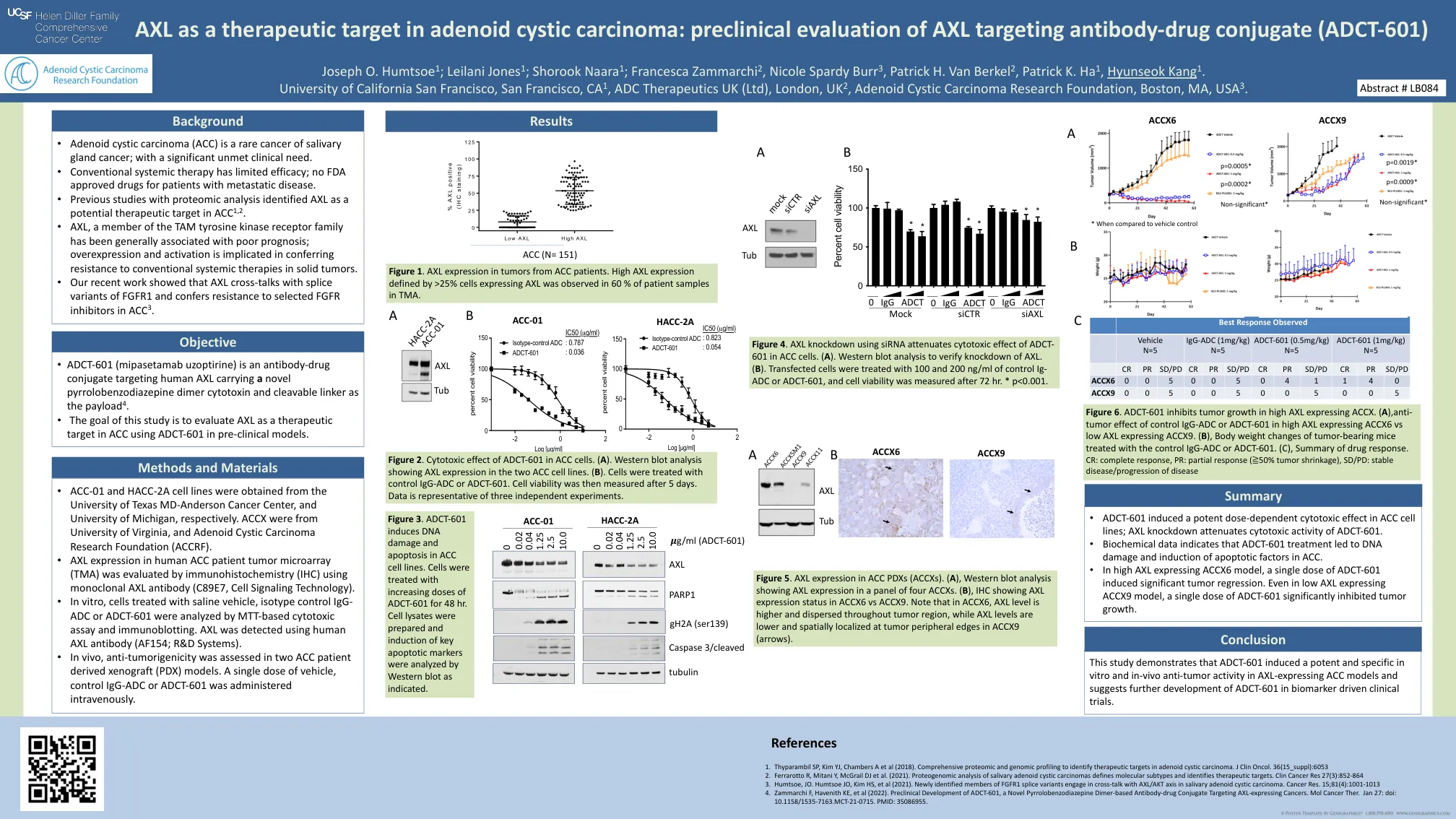
AXL 作为腺样囊性癌的治疗靶点:AXL 靶向抗体-药物偶联物 (ADCT-601) 的临床前评估
1. Thyparambil SP、Kim YJ、Chambers A 等人 (2018)。全面的蛋白质组学和基因组学分析以确定腺样囊性癌的治疗靶点。J Clin Oncol。36(15_suppl):6053 2. Ferrarotto R、Mitani Y、McGrail DJ 等人 (2021)。唾液腺腺样囊性癌的蛋白质组学分析定义了分子亚型并确定了治疗靶点。Clin Cancer Res 27(3):852-864 3. Humtsoe, JO。Humtsoe JO、Kim HS 等人 (2021)。新发现的 FGFR1 剪接变体成员与唾液腺腺样囊性癌中的 AXL/AKT 轴发生串扰。Cancer Res。 15;81(4):1001-1013 4. Zammarchi F、Havenith KE 等人 (2022)。ADCT-601 是一种新型吡咯并苯二氮卓二聚体抗体-药物偶联物,靶向表达 AXL 的癌症,临床前开发。Mol Cancer Ther. 1 月 27 日:doi: