XiaoMi-AI文件搜索系统
World File Search System缺氧与肌层浸润性膀胱癌中免疫浸润增加以及抗肿瘤和免疫抑制信号传导有关
摘要:缺氧和抑制性肿瘤微环境 (TME) 都是肌层浸润性膀胱癌 (MIBC) 的独立负面预后因素,会导致治疗耐药性。缺氧已被证明可通过募集抑制抗肿瘤 T 细胞反应的髓样细胞来诱导免疫抑制性 TME。最近的转录组分析表明,缺氧会增加膀胱癌中的抑制和抗肿瘤免疫信号和浸润。本研究旨在探讨缺氧诱导因子 (HIF)-1 和 -2、缺氧与 MIBC 中免疫信号和浸润之间的关系。进行 ChIP-seq 以鉴定在 1% 和 0.1% 氧气中培养 24 小时的 MIBC 细胞系 T24 基因组中的 HIF1 α、HIF2 α 和 HIF1 β 结合。使用了在 1%、0.2% 和 0.1% 氧气下培养 24 小时的四种 MIBC 细胞系 (T24、J82、UMUC3 和 HT1376) 的微阵列数据。使用两组膀胱癌队列 (BCON 和 TCGA) 的计算机模拟分析研究了高氧和低氧肿瘤之间的免疫环境差异,并过滤以仅包括 MIBC 病例。将 GO 和 GSEA 与 R 包“limma”和“fgsea”一起使用。使用 ImSig 和 TIMER 算法进行免疫反卷积。所有分析均使用 RStudio。在缺氧条件下,HIF1 α 和 HIF2 α 分别与 ~11.5–13.5% 和 ~4.5–7.5% 的免疫相关基因结合(1–0.1% O 2 )。 HIF1 α 和 HIF2 α 均与与 T 细胞活化和分化信号通路相关的基因结合。HIF1 α 和 HIF2 α 在免疫相关信号传导中具有不同的作用。HIF1 与干扰素产生有关,而 HIF2 与一般细胞因子信号传导以及体液和 Toll 样受体免疫反应有关。中性粒细胞和髓系细胞信号传导在缺氧条件下丰富,同时与 Tregs 和巨噬细胞相关的标志性通路也丰富。高缺氧 MIBC 肿瘤抑制和抗肿瘤免疫基因特征的表达增加,并与免疫浸润增加有关。总体而言,缺氧与抑制和抗肿瘤相关免疫信号传导和免疫浸润的炎症增加有关,如在体外和原位使用 MIBC 患者肿瘤所见。
imfinzi(durvalumab)
和B淋巴细胞。PD-L1的正常功能是通过与2种受体,编程的Death-1(PD-1)和CD80相互作用来调节T细胞激活与公差之间的平衡。癌细胞可以使用免疫检查点途径逃脱抗肿瘤免疫攻击。由于PD-L1也用肿瘤表达,因此它在多个部位起作用以帮助肿瘤逃避宿主免疫系统的检测和消除。在淋巴结中,在活化的T细胞上与PD-1或CD80结合的抗原呈递细胞(APC)上的Pd-L1在T细胞上为T细胞传递抑制信号。同样,在T细胞上,CD80对APC与PD-L1的结合会导致T细胞中的抑制信号传导。这些双向相互作用导致循环中T细胞激活的进一步抑制和较少的激活T细胞。在肿瘤环境中,在肿瘤细胞上表达的PD-L1与激活的T细胞达到肿瘤的PD-1结合。这向那些T细胞发出了抑制信号,阻止了它们杀死靶肿瘤细胞,从而保护肿瘤免疫消除。3 durvalumab(Imfinzi®)是人类免疫球蛋白G1 kappa(IgG1κ)单克隆抗体,与PD-L1结合并阻止PD-L1与PD-1和PD-1和CD80(B7.1)的相互作用(B7.1)。PD-L1/PD-1和PD-L1/CD80相互作用的阻塞释放了免疫反应的抑制,而无需诱导抗体依赖性细胞介导的细胞毒性(ADCC)。1
PE抗人CD152(CTLA-4)抗体
描述 CD152 也称为细胞毒性 T 淋巴细胞抗原 4 (CTLA-4),是免疫球蛋白超家族中 33 kD 的成员。它在活化的 T 细胞上暂时表达。CTLA4 在辅助 T 细胞表面表达,并向 T 细胞传递抑制信号。调节性 T 细胞表达高水平的 CTLA-4。CTLA-4 (CD152) 在氨基酸序列、结构和基因组组织方面与 CD28 相似。CD28 在 T 细胞活化中传递共刺激信号,而 CTLA-4 通过与抗原呈递细胞 (APC) 上的 CD80 (B7-1) 和 CD86 (B7-2) 相互作用,负向调节细胞介导的免疫反应。CTLA-4 被认为在诱导和维持免疫耐受以及发展保护性免疫和胸腺细胞调节中发挥作用。
肠道微生物组对肝细胞癌免疫疗法抗性的影响:评论文章
近年来,由于免疫疗法的出现,例如免疫检查点抑制剂(ICI)[4],HCC的治疗方面取得了显着突破。其中,细胞毒性T淋巴细胞抗原4(CTLA-4)抑制剂(ipilimumab)和PD-1抑制剂(Nivolumab,Pembrolizumab)在HCC管理中显示出令人鼓舞的结果[5]。尽管这些疗法的作用机理在其他地方进行了综述,但简要概述如下:在免疫细胞表面发现了编程的死亡(PD)-1蛋白,并且属于CD-28蛋白质家族[4]。PD-1与靶细胞上PD-1与程序性死亡配体(PDL)-1或PDL-2的结合抑制了免疫系统的反应,最终导致外周耐受性和恶性细胞的生长。阻断PD-1与其受体的结合可以防止这种抑制信号,并帮助免疫系统安装适应性的,有针对性的反应[6]。
免疫检查点抑制剂和急性间质性肾炎
免疫检查点抑制剂 (ICI) 是一类免疫治疗药物,它为多种恶性肿瘤(包括对传统疗法有耐药性或处于晚期的恶性肿瘤)提供了新的治疗选择,从而改变了癌症治疗。目前,它们单独使用或与其他治疗方法联合用于黑色素瘤、肺癌、肾细胞癌、膀胱癌和霍奇金淋巴瘤患者 [1,2]。ICI 是单克隆抗体,靶向 T 细胞、其他免疫细胞和肿瘤细胞上表达的抑制性受体。它们对被认为是适应性免疫反应重要突破点(或检查点)的分子具有抑制作用,如细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA- 4)、程序性细胞死亡蛋白 1 (PD-1) 和程序性死亡配体 1 (PDL-1) [2]。CTLA-4 在 T 细胞上上调并与共刺激 CD28 配体分子竞争,导致抑制信号和 T 细胞停滞。 CTLA-4 阻断剂(例如
针对肿瘤微环境的免疫治疗策略开发正在激烈进行中
肿瘤免疫微环境是一个非常复杂的系统,受多种因素影响;在该微环境中,各种免疫细胞、基质细胞和细胞因子可以与肿瘤细胞相互作用,共同调节这个复杂的生态系统。在肿瘤发展过程中,肿瘤微环境 (TME) 表现出抑制信号的上调和激活信号的下调,从而形成免疫抑制微环境并导致肿瘤免疫逃逸。近年来,已经开发出多种精准免疫治疗策略,通过刺激或恢复免疫系统固有的肿瘤抑制能力,将 TME 重塑为积极的免疫微环境,以提高抗肿瘤治疗效果。本文主要介绍针对肿瘤微环境的免疫治疗策略,包括针对微环境抑制信号传导、激活信号传导的策略,具体涉及物理屏障、免疫细胞及其表面分子受体、细胞因子、代谢因子等多个新靶点,并总结了肿瘤免疫微环境研究中面临的挑战及相应的解决方案。
PD-L1 与 B7-1 顺式相互作用
免疫检查点会负面调节免疫细胞反应。程序性细胞死亡蛋白 1:程序性死亡配体 1 (PD-1:PD-L1) 和细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA-4):B7-1 是最重要的免疫检查点通路之一,也是免疫疗法的关键靶点,免疫疗法旨在调节刺激信号和抑制信号之间的平衡,从而获得良好的治疗效果。目前对这两条免疫检查点通路的教条认为它们是独立的,没有相互作用。然而,新近鉴定的 PD-L1:B7-1 配体 - 配体顺式相互作用及其结合 CTLA-4 和 CD28 但不结合 PD-1 的能力表明这些通路具有显著的串扰。在此,我们提出 PD-L1:B7-1 顺式相互作用带来了对这些途径的新的机制理解、对当前免疫疗法机制的新见解以及在各种治疗环境中开发更好的治疗方法的新思路。
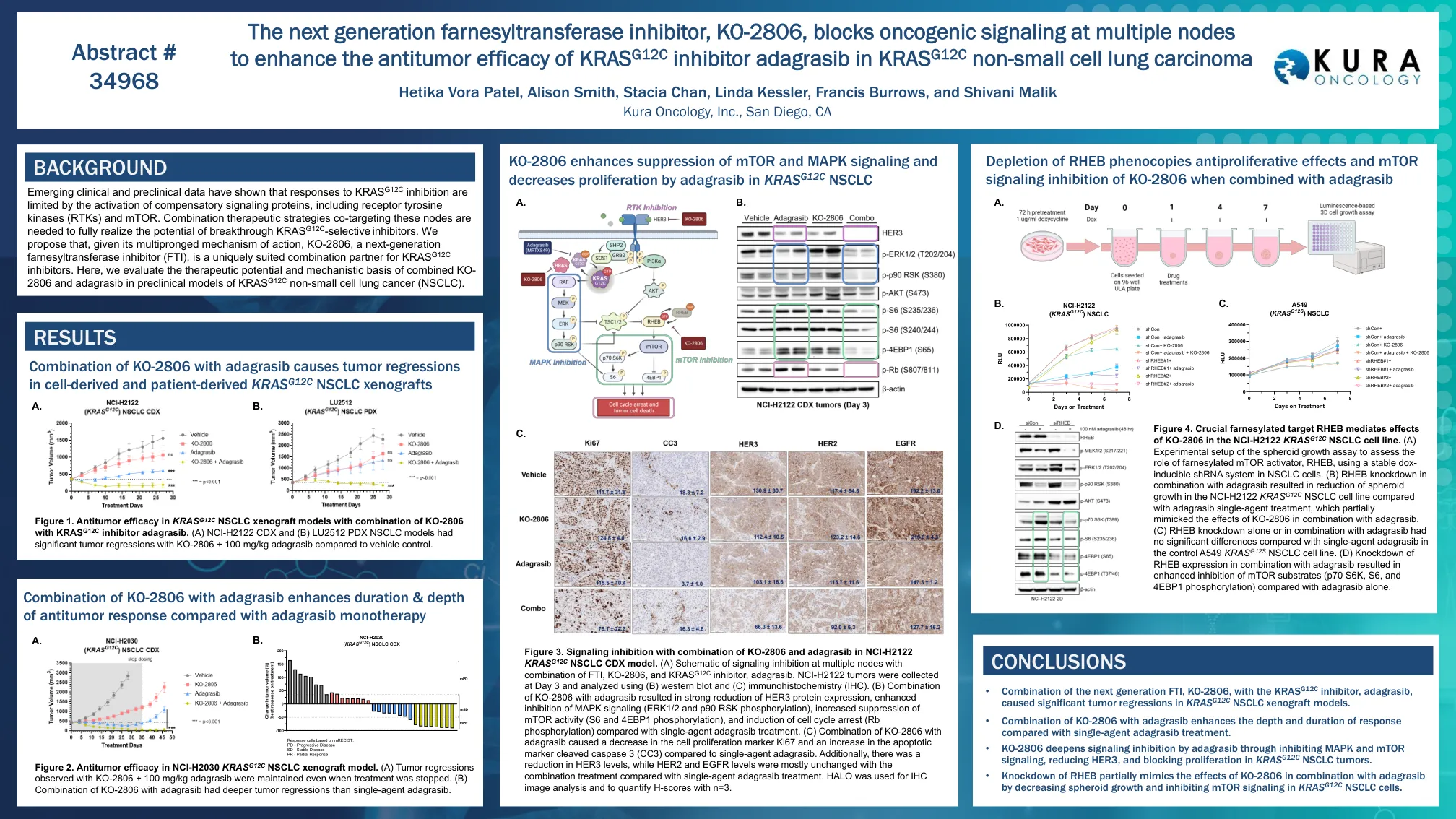
下一代Farnesylsylansferase抑制剂KO-2806,阻止多个节点的致癌信号传导,以增强KRAS G12的抗肿瘤功效
图3。NCI-H2122 KRAS G12C NSCLC CDX模型中KO-2806和Adagrasib结合使用的信号传导抑制。(a)在多个节点上抑制信号传导的示意图与FTI,KO-2806和KRAS G12C抑制剂Adagrasib的组合。NCI-H2122肿瘤,并使用(b)Western印迹和(c)免疫组织化学(IHC)分析。(b)KO-2806与AdagrasiB的组合导致HER3蛋白表达的大幅度降低,增强了对MAPK信号传导(ERK1/2和P90 RSK磷酸化)的抑制作用,增加了MTOR活性的抑制(S6和4EBP1磷酸化),以及对单个Cell Cycer Cyprant(RB Pranscratib)的抑制。(c)KO-2806与Adagrasib的组合导致细胞增殖标记Ki67的降低,而与单药adagrasib相比,凋亡标记裂解的caspase 3(CC3)的增加。此外,与单药Adagrasib治疗相比,HER3水平降低了,而HER2和EGFR水平的组合处理大多是没有变化的。halo用于IHC图像分析,并用n = 3量化H得分。
外周血细胞计数作为免疫的预测指标......
癌症免疫疗法已成为治疗各种恶性肿瘤的突破性进展。ICI 靶向 PD-1/PD-L1 和 CTLA-4 通路,通过阻断抑制信号、激活 T 细胞和重振抗肿瘤免疫反应发挥作用。然而,通过增强宿主的免疫反应和破坏免疫稳态,ICI 可促进炎症活动,可能导致多个器官的炎症相关损害 ( 1 )。这表现为一系列临床症状,统称为 irAE,通常影响各种器官系统,包括皮肤、内分泌、呼吸和胃肠系统 ( 2 )。irAE 的发病率相对较高,某些严重并发症会显著影响患者的生活质量和预后 ( 3 )。有效管理 irAE 而不损害 ICI 的抗肿瘤效果或患者的长期生存率仍然是一项临床挑战 ( 4 )。值得注意的是,发生 irAE 的患者通常会获得更好的癌症治疗结果(5-7)。因此,提前评估个人毒性风险至关重要,因为早期干预和管理 irAE 可以帮助确保高风险患者继续接受 ICI 治疗并从中受益。
与黑色素瘤免疫治疗相关的皮肤事件:综述
免疫系统在黑色素瘤病程中的作用已得到充分证实。免疫检查点抑制剂在增强免疫系统对抗癌细胞方面显示出良好的前景,并且比过去使用的化疗有更高的反应率 [ 1 , 2 ]。肿瘤细胞通过表达免疫检查点通路的配体来灭活免疫监视过程。免疫检查点抑制剂 (ICI) 是针对两种免疫检查点通路的单克隆抗体:(1) 细胞毒性 T 淋巴细胞抗原 4 (CTLA-4),由活化的 T 细胞表达,在免疫反应期间向 T 细胞活化传递抑制信号,以及 (2) 程序性死亡-1 蛋白 (PD-1),促进淋巴结中 T 细胞凋亡并减少调节性 T 细胞凋亡。T 细胞的这种激活也可能是影响不同器官和系统的免疫相关不良反应 (AE) 发生的原因;尤其是接受 ICI 治疗的患者中,多达 30%–50% 的患者报告出现皮肤相关不良反应 [ 3 ]。在此,我们回顾了 ICI 引起的主要色素沉着变化:白癜风的出现、萨顿现象、黑变病以及头发和指甲毒性。