XiaoMi-AI文件搜索系统
World File Search System[干细胞生物学]
阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预阿斯桑医学中心儿童医院儿科科学系,乌尔山大学医学院P-065严重的肝曲正弦障碍综合症(SOS)案例,HLA半合并后,通过使用Hokus-10术语SOS来挽救生命后,HLA半融合后的疾病后,hla半融合后的疾病后,该病房均可通过诊断和干预措施来挽救生命。基于Hokus-10的早期干预
转录重编程恢复全脑范围内的 UBE3A,并挽救 Angelman 综合征小鼠模型中的行为表型
天使综合征 (AS) 是一种由大脑中泛素连接酶 E3A (UBE3A) 基因表达缺失引起的神经遗传疾病。UBE3A 基因在脑神经元中是父系印记。AS 的临床特征主要是由于大脑中母系表达的 UBE3A 缺失所致。大脑中存在父系 UBE3A 的健康拷贝,但被长非编码反义转录本 (UBE3A-ATS) 沉默。在这里,我们证明人工转录因子 (ATF-S1K) 可以在成年小鼠天使综合征 (AS) 模型中沉默 Ube3a-ATS 并恢复父系 Ube3a 的内源性生理表达。向尾静脉单次注射表达 ATF-S1K 的腺相关病毒 (AAV) (AAV-S1K) 即可实现全脑转导,并将神经元中的 UBE3A 蛋白恢复至野生型蛋白的 25%。ATF-S1K 治疗对靶位点具有高度特异性,在 AAV-S1K 给药 5 周后未检测到炎症反应。AAV-S1K 治疗 AS 小鼠在探索性运动(涉及粗大和精细运动能力的任务)中表现出行为恢复,类似于 AS 患者的低步行和速度。单次注射 AAV-S1K 治疗 AS 的特异性和耐受性表明 ATF 可作为 AS 的一种有前途的转化方法。
晚期小肠胃肠道间质瘤四线挽救治疗利普替尼取得部分缓解:一例病例报告
结论:伊马替尼作为晚期GIST的首选靶向治疗药物,临床疗效显著。伊马替尼治疗局部性肿瘤进展后,可二线使用舒尼替尼。伊马替尼和舒尼替尼均治疗失败的GIST患者可考虑三线使用瑞戈非尼治疗。本例患者使用瑞戈非尼治疗后出现PD,使用瑞普替尼后获得满意疗效。对于GIST患者,在伊马替尼、舒尼替尼、瑞戈非尼治疗失败后,瑞普替尼作为一种新型靶向药物,可取得良好的治疗效果。瑞普替尼目前被批准用于晚期GIST的四线及以上治疗,但瑞普替尼在转移性或晚期GIST中的最终地位仍有待研究。本例患者通过瑞普替尼治疗取得PR的治疗效果,除出现脱发外,无其他明显副作用。我们的研究结果可能会为 GIST 的治疗提供临床决策参考。
关于严重腿部和足部创伤的截肢与重建的当前证据
肢体残缺严重程度评分 (MESS) 预测挽救指数 (PSI) 肢体挽救指数 (LSI) 神经、缺血、软组织、骨骼、休克、年龄评分 (NISSSA) 汉诺威骨折量表 97 (HFS)
自体干细胞移植患有难治性或早期复发的大型B细胞淋巴瘤的患者,对挽救化学疗法有反应
嵌合抗原受体T细胞疗法是适合难治性或早期复发大型B细胞淋巴瘤(DLBCL)患者的新护理标准。然而,在某些情况下(例如,缺乏用于嵌合抗原受体T细胞疗法的资源,化学的现场复发),挽救化学疗法(ST)和自体干细胞移植(ASCT)仍然可能有作用。我们回顾性地研究了230例患有ST和ASCT的难治性或早期复发的DLBCL患者。ST的中间线是一个(范围1-3)。在106例(46%)和124名患者中,ASCT之前的最佳反应是完全反应(46%)和部分反应。ASCT后的中位随访时间为89.4个月。中值无进展(PFS)和总生存期(OS)分别为16.1和43.3个月。一线治疗后6至12个月复发的患者的中位PFS(29.6个月)和OS(88.5个月)。需要一条ST的患者与需要多个线路的患者相比,PFS的中位数更好(37.9vs。3.9个月; p = 0.0005)和OS(68.3 vs。12.0个月; p = 0.0005)。达到完全反应的患者中位PFS更好(71.1 vs。6.3个月; p <0.0001)和OS(110.3 vs。18.9个月; p <0.0001)比部分响应的p <0.0001。一线ST之后达到完全反应的患者的中位PFS(88.5个月)和OS(117.2个月)。ASCT后的生存后生存结果或早期复发DLBCL的患者似乎是合理的,并且在那些仅要求一系列ST以在ASCT之前实现完全反应的人尤其有利,从而突出了该过程在选择具有化学敏感性疾病的PAPET中的作用。
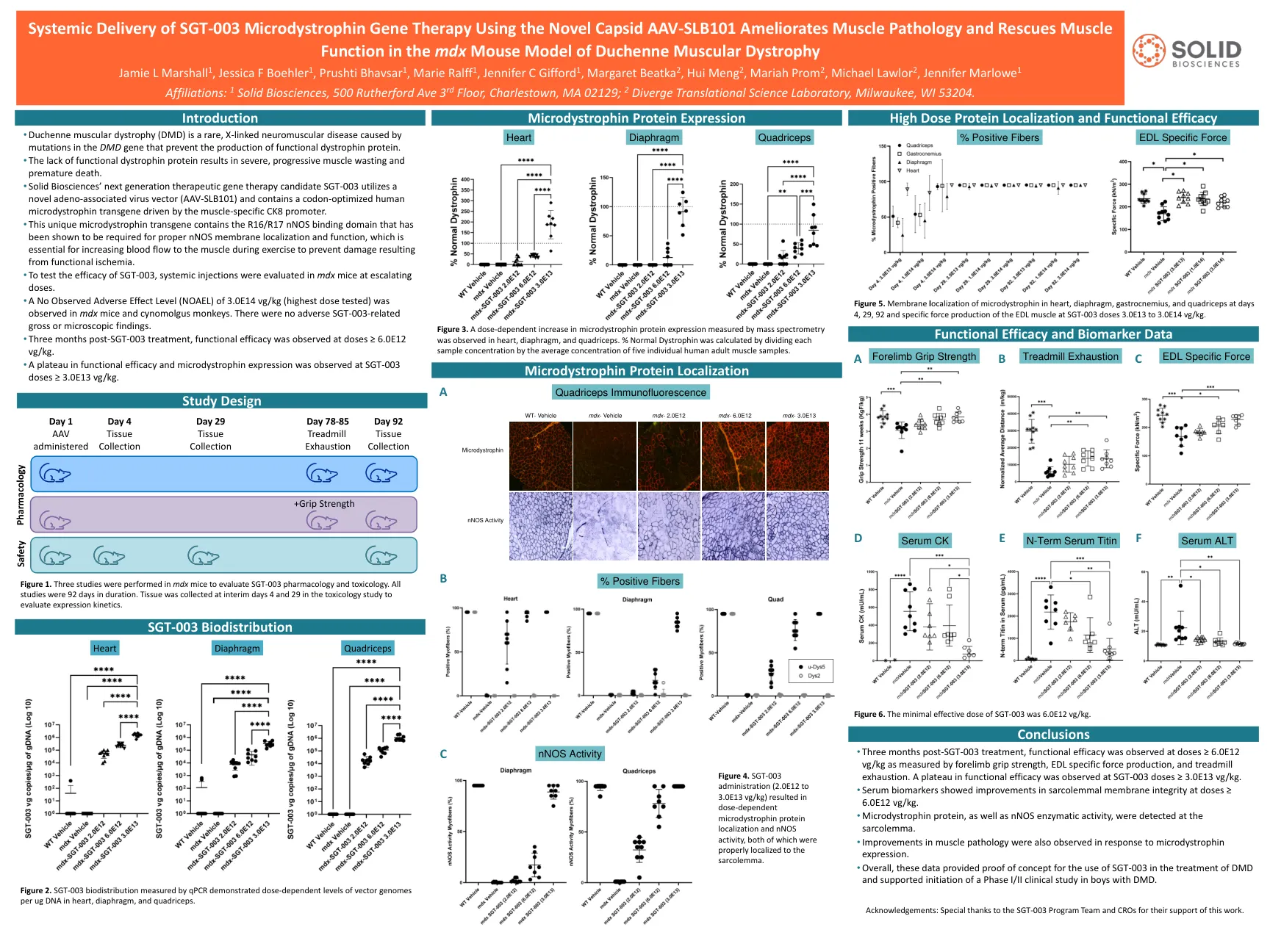
使用新型的CAPSID AAV-SLB101的SGT-003微型肌营养物基因疗法的全身递送可改善肌肉病理学并挽救肌肉
被证明是适当的NNOS膜定位和功能所必需的,这对于在运动过程中增加血液流向肌肉以防止功能性缺血引起的损害至关重要。•为了测试SGT-003的功效,在MDX小鼠中评估了全身注射
用 IL-15 和 IL-18 进行预处理可挽救冷冻保存后自然杀伤细胞免于颗粒酶 B 介导的细胞凋亡
基于人类自然杀伤 (NK) 细胞的疗法正在接受用于治疗各种癌症的评估,但冷冻保存会降低 NK 细胞的恢复率和功能,从而限制了其治疗可行性。使用针对 T 细胞优化的冷冻保存方案,我们发现约 75% 的 NK 细胞在解冻后 24 小时内死亡,其余细胞的细胞毒性降低。使用 CRISPR-Cas9 基因编辑和共聚焦显微镜,我们发现冷冻保存的 NK 细胞大部分通过由细胞毒性囊泡中颗粒酶 B 泄漏引发的细胞凋亡而死亡。在冷冻保存之前用白细胞介素 15 (IL-15) 和 IL-18 的组合对 NK 细胞进行预处理可将 NK 细胞恢复率提高到约 90-100%,并且与未冷冻保存的 NK 细胞相比,在播散性 Raji 细胞淋巴瘤异种移植模型中实现相同的肿瘤控制率。 IL-15 和 IL-18 诱导的保护机制包括两种机制:通过脱颗粒暂时降低细胞内颗粒酶 B 水平,以及诱导抗凋亡基因。
选择性抑制少突胶质细胞衍生的淀粉样蛋白β可挽救阿尔茨海默病中的神经元功能障碍
阿尔茨海默病 (AD) 是一种严重的神经退行性疾病,影响着全球数百万人。淀粉样β蛋白 (A β ) 的积累是该疾病的早期关键标志,因此是了解病理生理学和治疗的重要目标。最近的临床试验表明,使用抗 A β 抗体治疗的 AD 患者的认知和功能衰退减缓,这确实强化了 A β 在 AD 病理生理学中的重要作用 [1,2]。神经元对 A β 积累的最早反应之一是兴奋性异常增加 [3,4]。然而,神经元并不是唯一对 A β 有反应的细胞。最近,转录组研究表明,在人类 AD 组织 [5,6] 和小鼠 AD 模型 [7,8] 中,不仅小胶质细胞和星形胶质细胞发生了变化,而且少突胶质细胞(中枢神经系统的髓鞘细胞)也发生了变化。此外,与 AD 相关的遗传风险

![[干细胞生物学]](/simg/3\374ded6653a0bb29692e58657fc94cc0e47ca733.webp)