XiaoMi-AI文件搜索系统
World File Search System催化无活性 CRISPR 的新兴应用-...
摘要 rRNA、tRNA、mRNA和非编码RNA等不同类型RNA的转录后调控广泛参与生理和疾病的发生发展。mRNA作为基因与蛋白质之间的中间产物,其可变剪接、可变多聚腺苷酸化和修饰等转录后调控影响其编码蛋白的表达和功能。然而,由于缺乏合适的RNA工程平台,RNA转录后调控的功能意义和治疗潜力尚未得到充分研究。2015年一种特异性靶向RNA模板的新型CRISPR-Cas系统CRISPR-Cas13的发现,赋予了CRISPR以高特异性靶向和编辑RNA的新作用,在一定程度上开启了RNA操作的新时代。本综述将总结催化无活性的CRISPR-Cas13系统(CRISPR-dCas13)在mRNA工程中的新兴应用,并强调CRISPR-dCas13系统在其他RNA修饰调控中的前景及其治疗潜力。
胶原蛋白羟化酶在培养的成纤维细胞中的无活性前体的免疫学证据
摘要在正常生长过程中,在培养的小鼠成纤维细胞(L-929细胞)中,在培养的小鼠成纤维细胞(L-929细胞)中,在其他条件下以及导致酶活性增加的培养小鼠成纤维细胞(L-929细胞)中,已使用一种对大鼠胶原蛋白羟化酶的特异性抗体。胶原蛋白羟化酶活性每毫克细胞蛋白的活性增加了24倍,因为细胞通过对数发展到生长的固定阶段,而免疫反应性蛋白的细胞融合仅略有变化。在早期对数阶段的细胞中获得了相似的结果,其中通过细胞浓度或乳酸处理刺激酶活性,而没有相应的细胞抗原变化。还显示,这些成纤维细胞中的酶无活性抗原有效地竞争了具有部分纯化酶的抗体结合位点。可以得出结论,早期含量的成纤维细胞包含一种胶原蛋白脯氨酸羟化酶的非活性形式,这可能是功能性酶的前体。
药物前体综述
术语“前药”或“前体药物”最早由 Albert 于 1958 年提出。前药是无活性化合物,在体内代谢时,可通过化学或酶促方式产生活性母体药物。前药被定义为在发挥治疗作用之前经历生物转化的化合物 (1)。实际上,这些是药物分子的生物可逆衍生物,它们在体内经历酶促和/或化学转化以释放活性母体药物,然后发挥所需的药理作用。其中活性部分与无活性部分连接,必须在体内通过酶的作用将其分解。重要的是,无活性部分应无毒,最好能迅速从体内消除 (2)。因此,前药可被视为含有专门的无毒保护基的药物,以短暂的方式使用,以改变或消除母体药物中的不良特性。前药设计需要克服许多配方、药代动力学或药效学缺点。突出的缺点包括
定量轨道分析的原始文章应用于评估坟墓眼科的活性
摘要:这项研究旨在评估眼外肌肉(EOM),泪腺和视神经中摄取比的诊断价值,以使用99m TC TC酸(99m tc)酸(DC) - 纤维酸(DISETHENEPA DIIETHYLENEPAINAM)进行定量分析,以检测坟墓的眼科(GO)的炎症活性(GO)轨道单光子发射计算机断层扫描/计算机断层扫描(SPECT/CT)图像。根据其临床活动评分,将患者分为活性阶段(临床活动评分≥3/7,n = 23)或不活跃阶段(临床活动评分<3/7,n = 38)。摄取比通过将感兴趣的区域放置在最高吸收区域内,如共识,EOM,泪腺和视神经所同意,并在用于CT衰减的SPECT图像上。与无活性GO患者相比,活跃GO的患者在EOM,泪腺和视神经中表现出明显更高的摄取比(所有P <0.01)。这些参数已被证明可有效区分活性和无活性疾病。
IK-595,一种MEK/RAF复合物抑制剂,避免了CRAF介导的... ik-930,一种用于治疗YAP/TAZ-TEAD依赖性癌症的Tead Paralog选择性抑制剂
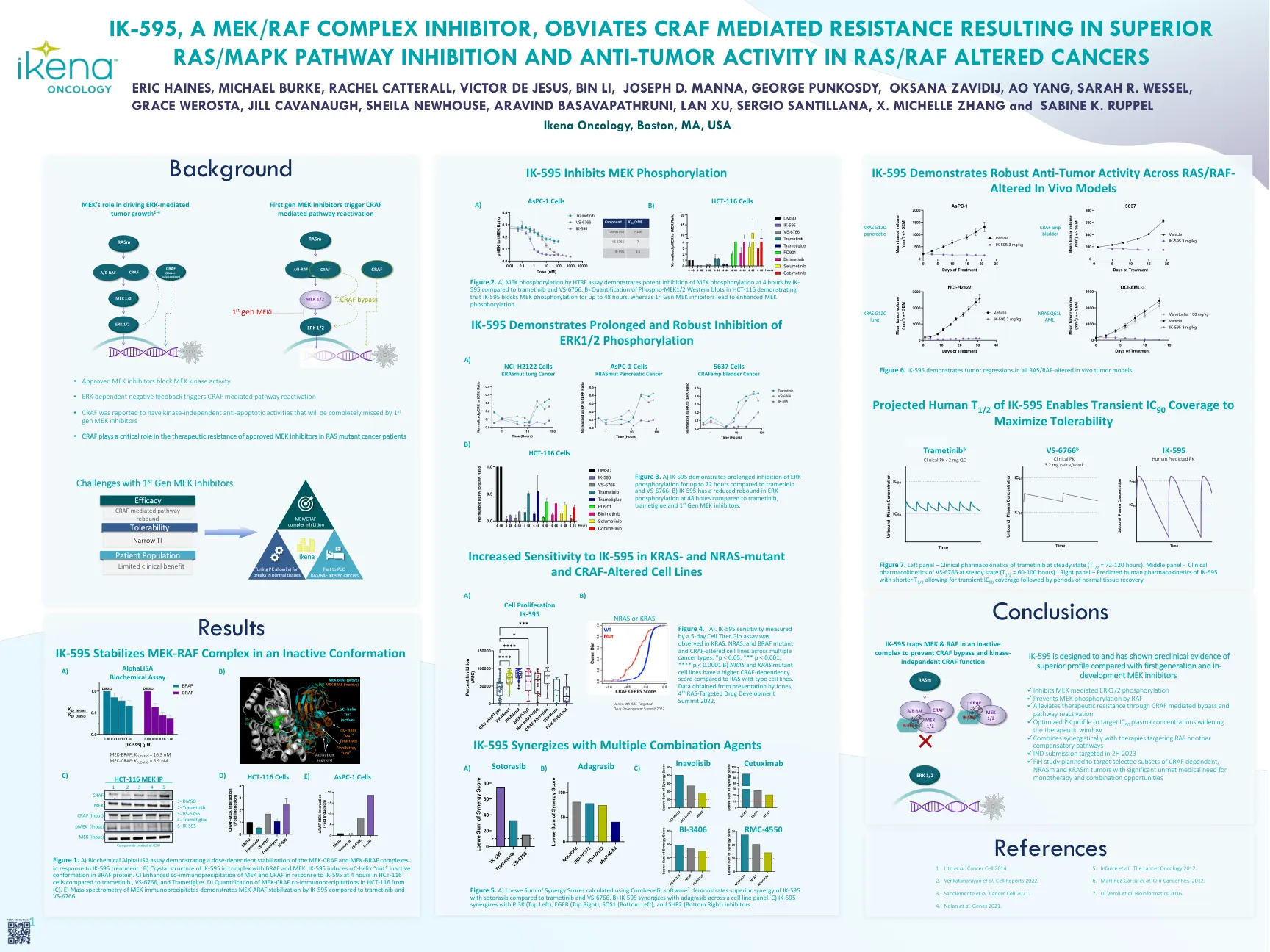
图1。a)生化α分析,表明对IK-595处理的MEK-CRAF和MEK-BRAF复合物的剂量依赖性稳定。b)IK-595的晶体结构与BRAF和MEK在复合体中。IK-595在BRAF蛋白中诱导C螺旋“ OUT”无活性构象。 c)与Trametinib,VS-6766和Trametiglue相比,HCT-116细胞在HCT-116细胞中对IK-595的响应增强了MEK和CRAF的共免疫沉淀。 d)(c)中HCT-116中MEK-CRAF共免疫沉淀的定量。 e)MEK免疫沉淀物的质谱法证明了与Trametinib和VS-6766相比,IK-595的MEK-ARAF稳定。IK-595在BRAF蛋白中诱导C螺旋“ OUT”无活性构象。c)与Trametinib,VS-6766和Trametiglue相比,HCT-116细胞在HCT-116细胞中对IK-595的响应增强了MEK和CRAF的共免疫沉淀。d)(c)中HCT-116中MEK-CRAF共免疫沉淀的定量。e)MEK免疫沉淀物的质谱法证明了与Trametinib和VS-6766相比,IK-595的MEK-ARAF稳定。
第六章 预防和治疗疾病
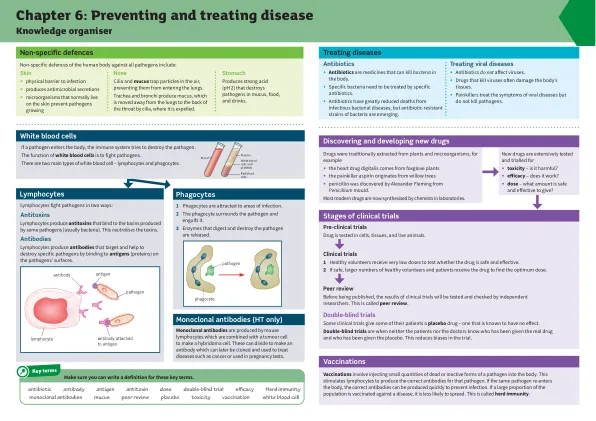
疫苗接种涉及将少量的死或无活性病原体注射到体内。这会刺激淋巴细胞产生针对该病原体的正确抗体。如果相同的病原体再次进入人体,可以快速产生正确的抗体来预防感染。如果大部分人口接种了某种疾病的疫苗,该疾病传播的可能性就会降低。这被称为群体免疫。
HDAC 抑制剂衍生物通过两种不同且可分离的机制诱导白血病细胞分化
急性髓系白血病 (AML) 是一种造血系统恶性肿瘤,包含不同的遗传亚型,但具有分化停滞的共同特征。在异常造血中,克服分化阻滞已成为一种有吸引力的治疗策略。在对遗传上不同的 AML 细胞系进行筛选时,观察到组蛋白去乙酰化酶抑制剂 (HDACis) 导致髓系分化标志物 CD11b 表达上调。这些导致细胞形态发生变化、增殖受阻和细胞周期停滞在 G1 期。为了深入了解这些化合物的作用机制,我们计划制备不含锌结合基序的无活性探针。然而,这些化合物出乎意料地仍然能够启动分化,尽管是通过不同的靶标和 G2 停滞。后续的 RNA 测序研究支持 HDACis 的分化表型,并强调了细胞周期调节激酶在探针分子中观察到的影响中的作用。我们随后发现这些化合物可抑制 Aurora A 和 GSK3α 激酶,表明它们有潜力成为 AML 分化治疗的治疗靶点。我们的工作支持了正确验证无活性工具化合物及其识别新靶点的潜力的重要性。
芦可替尼用于治疗 12 岁及以上人群的非节段性白癜风 [ID3998]
背景 • 公司的定位:年龄≥12 岁,面部受累的非节段性白癜风 (NSV) 患者,对局部皮质类固醇或局部钙调磷酸酶抑制剂治疗无效,或不适合这些治疗 → 比营销授权范围更窄(允许一线使用) • 公司认为在局部一线治疗之后和光疗之前,治疗途径中存在一个患者无需接受治疗的位置 → 公司的对照品为无活性治疗(载体霜)
肠道菌群作为心理和身体健康的关键
炎症性肠病炎症性肠病(IBD)是一种慢性胃肠道疾病。IBD包括克罗恩病(CD)和溃疡性结肠炎(UC)。 值得注意的是,与没有IBD的无活性CD或健康个体的患者相比,活性CD患者的肠道菌群稳定[Sepehri等,2007]。 肠道菌群破坏的长期作用,以及肠道中的病原体的丰富度增加,即使在没有炎症的疾病稳定时期,也可能会影响肠道通透性[Vivinus-Nébot等人,2014年]。 CD的发展已显示与肠道通透性的增加有关。 这证实了改变的肠道屏障功能有助于发病机理,任何异常都可以作为发生CD的风险的生物标志物[Turpin等,2020]。IBD包括克罗恩病(CD)和溃疡性结肠炎(UC)。值得注意的是,与没有IBD的无活性CD或健康个体的患者相比,活性CD患者的肠道菌群稳定[Sepehri等,2007]。肠道菌群破坏的长期作用,以及肠道中的病原体的丰富度增加,即使在没有炎症的疾病稳定时期,也可能会影响肠道通透性[Vivinus-Nébot等人,2014年]。CD的发展已显示与肠道通透性的增加有关。这证实了改变的肠道屏障功能有助于发病机理,任何异常都可以作为发生CD的风险的生物标志物[Turpin等,2020]。
Moderna Covid-19疫苗
有关药物是否含有PEG,PEG衍生物或多渗透性的信息,可以在软件包插入物中找到活性或无活性成分。国立卫生研究院Dailymed数据库(https://dailymed.nlm.nih.gov/dailymed/index.cfm)也可以用作资源。在Stone Ca等人的补充材料中也描述了含有钉和/或多氧化盐的药物。“对聚乙烯甘油和多晶质的直接过敏:比我们认识的更常见。”过敏和临床免疫学杂志:实践7.5(2019):1533–1540。https://www.ncbi.nlm.nih。gov/pmc/articles/pmc6706272/pdf/nihms-1019221.pdf






![芦可替尼用于治疗 12 岁及以上人群的非节段性白癜风 [ID3998]](/simg/0\0f225673ea9b021e98d8c87a7a8b154fbfb10f13.webp)

