XiaoMi-AI文件搜索系统
World File Search System探索睡眠心率变异性:线性、非线性和昼夜节律视角
结果:在线性分析的频率分析中,睡眠期间的副交感神经指数 nHF 明显高于平均 24 小时周期(平均睡眠 HRV [标准差] vs. 平均 24 小时 [标准差],95% 置信区间,p 值,r 系列:0.24 [0.057] vs. 0.23 [0.045],0.006–0.031,p = 0.005,r = 0.49)。关于时间域分析,副交感神经指数 SDNN 和 RMSSD 在睡眠期间也明显较高(SDNN:179.7 [66.9] vs. 156.6 [53.2],14.5–31.7,p < 0.001,r = 0.71 RMSSD:187.0 [74.0] vs. 165.4 [62.2],13.2–30.0,p < 0.001,r = 0.70)。在非线性分析的几何方法中,副交感神经指数 SD1 和 SD2 在睡眠期间显示出明显更高的值(SD1:132.4 [52.4] vs. 117.1 [44.0],9.3–21.1,p < 0.001,r = 0.70 SD2:215.0 [80.5] vs. 185.9 [62.0],17.6–40.6,p < 0.001,r = 0.69)。此外,副交感神经指数 SDNN、RMSSD、SD1 和 SD2 的昼夜节律项目在睡眠期间呈现正峰值。
妊娠期睡眠和昼夜节律、社会劣势以及新生儿大脑发育的改变
Adamson, CL、Alexander, B.、Ball, G.、Beare, R.、Cheong, JLY、Spittle, AJ、Doyle, LW、Anderson, PJ、Seal, ML 和 Thompson, DK (2020)。使用基于表面的墨尔本儿童区域婴儿大脑图谱 (M-CRIB-S) 对新生儿皮质进行分区。科学报告 (Sci Rep),10,4359。Ahmad, SI、Rudd, KL、Lewinn, KZ、Mason, WA、Murphy, L.、Juarez, PD、Karr, CJ、Sathyanarayana, S.、Tylavsky, FA 和 Bush, NR (2021)。母亲童年创伤和产前压力与儿童行为健康有关。健康与疾病发育起源杂志,13,483–493。 https://doi.org/10.1017/s2040174421000581 Alexander, B., Murray, AL, Loh, WY, Matthews, LG, Adamson, C., Beare, R., Chen, J., Kelly, CE, Rees, S., Warfield, SK, Anderson, PJ, Doyle, LW, Spittle, AJ, Cheong, JLY, Seal, ML, & Thompson, DK (2017)。新生儿皮质和皮质下大脑新图谱:墨尔本儿童区域婴儿大脑 (M-CRIB) 图谱。神经影像学,147,841–851。Allada, R. 和 Bass, J. (2021)。医学中的昼夜节律机制。新英格兰医学杂志,384,550–561。
昼夜节律作为发育期间和整个衰老期间大脑健康的调节剂
由于开发这些模型的个人重点,新鼠标模型的抽象全面详细表征可能会具有挑战性。经常设计用于在有限数量的组织,阶段和/或其他情况下测试特定假设的模型。该模型是否会产生所需的表型,超出所需环境的表型可能是非常重要的工作密集型,并且通常不进行这些研究。但是,更广泛的表型引起的一般信息对于更广泛的科学界来说是无价的。国际小鼠表型联盟(IMPC)及其子公司,例如淘汰小鼠项目(KOMP),在简化此过程方面取得了长足的进步。尤其是,在整个胎儿/发育阶段检查内部器官系统方面,Microct的使用一直是宝贵的资源。在这里,我们提供了几种新颖的小插曲,证明了Microct在基于人类疾病相关性和未预测的基于人类疾病相关性的心脏表型中的实用性。
研究昼夜节律途径和失眠风险基因对自闭症和睡眠障碍的贡献
睡眠障碍在自闭症谱系障碍(ASD)的青年中普遍存在。研究人员认为,昼夜节律功能障碍可能导致睡眠问题或加剧ASD症状。但是,这是有限的遗传证据。还不清楚一般人群中通过GWAS鉴定的失眠风险基因如何与ASD和常见的睡眠问题有关,例如ASD中的失眠性质。我们调查了包括昼夜节律途径基因和失眠风险基因对ASD风险以及ASD儿童的睡眠障碍的拷贝数变体(CNV)的贡献。我们研究了Simons Simplex Collection(SSC)和MSSNG数据库的5860 ASD Probands和2092个未受到影响的兄弟姐妹,以及来自两个未选择人群(Imagen and Generation scotland)的7509个人。睡眠持续时间和失眠症状是SSC概率的父母。我们分别识别335和616罕见的CNV,分别包含昼夜节律和失眠风险基因。与兄弟姐妹和未选择的对照相比,ASD概率中的缺失和复制在ASD检验中的代表性过高。 对于失眠风险基因,缺失(非重复)与两个队列中的ASD相关。 调整认知能力后,结果仍然很重要。 与含有其他基因的CNV相比,含有昼夜节律途径和失眠风险基因的 CNV与ASD的相关性更强。 昼夜节律基因不会影响ASD中的睡眠持续时间或失眠特征。 失眠的风险基因不耐受单倍努力的能力增加了复制时失眠的风险。缺失和复制在ASD检验中的代表性过高。对于失眠风险基因,缺失(非重复)与两个队列中的ASD相关。调整认知能力后,结果仍然很重要。与含有其他基因的CNV相比,含有昼夜节律途径和失眠风险基因的 CNV与ASD的相关性更强。 昼夜节律基因不会影响ASD中的睡眠持续时间或失眠特征。 失眠的风险基因不耐受单倍努力的能力增加了复制时失眠的风险。CNV与ASD的相关性更强。昼夜节律基因不会影响ASD中的睡眠持续时间或失眠特征。失眠的风险基因不耐受单倍努力的能力增加了复制时失眠的风险。CNV涵盖昼夜节律和失眠风险基因增加ASD责任,几乎没有对睡眠障碍的影响。
分子昼夜节律在缺乏有节奏行为的海洋annelids中很健壮
1 Max Perutz Labs,维也纳大学,维也纳生物中心,维也纳,奥地利,2 Alfred Wegener Institute Helmholtz极地和海洋研究中心,德国Bremerhaven,德国Bremerhaven,Vienna Biocenter Phd Proghna dienna Biocenter Phardienna dienna Biocation and Maxtienna,Vienna,Vienna,Vienna,Vienna,Vienna,Vienna,4佩鲁茨实验室,维也纳大学,维也纳医科大学,维也纳,奥地利,5动物生理学和神经生物学司,库尤文库芬,比利时,鲁南,6个神经和发育生物学系,维也纳大学,维也纳大学,维也纳大学,维也纳,奥地利,奥地利7研究平台,奥地利,奥法利亚,奥法利亚,奥法利亚,奥法利亚,奥地利,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳,维也纳。环境(ICBM),数学与科学学院,Carl von Ossietzky Universita tember,德国奥尔登堡
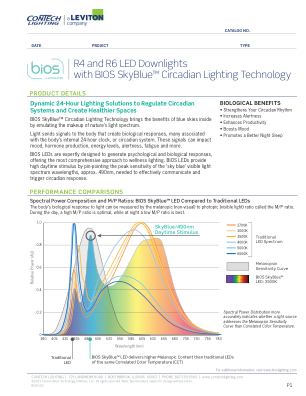
采用 BIOS SkyBlue™ 昼夜节律照明技术的 R4 和 R6 LED 筒灯
BIOS LED 经过精心设计,可产生心理和生物反应,提供最全面的健康照明方法。BIOS LED 通过精确定位“天蓝色”可见光谱波长的峰值灵敏度(约490nm,需要有效传达和触发昼夜节律反应。
早期生命的节奏:婴儿的肠道菌属节奏和昼夜节律成熟
(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此预印本版的版权持有人于2025年1月6日发布。 https://doi.org/10.1101/2025.01.06.631487 doi:biorxiv preprint
回顾昼夜节律、奖励回路和物质使用障碍(SUD)之间的复杂关系
1 印度西孟加拉邦米德纳普尔学院生理学系,邮编 721101;2 美国纽约州花园城阿德菲大学文理学院生物系及美国纽约州花园城阿德菲大学戈登 F. 德纳心理学院心理学系;3 美国德克萨斯州休斯顿德克萨斯南方大学药学院药学系,邮编 77004;4 美国密苏里州圣路易斯华盛顿大学医学院精神病学系;5 美国俄亥俄州克利夫兰凯斯西储大学医学院精神病学系;6 巴西米纳斯吉拉斯联邦大学生物科学研究所遗传学、生态学和进化系,邮编 31270-901; 7 综合组学和应用生物技术研究所,Nonakuri,Purba Medinipur,721172,西孟加拉邦,印度;8 西方健康科学大学体育、锻炼和心理健康中心成瘾研究与教育部,加利福尼亚州波莫纳,91766,美国;9 匈牙利布达佩斯罗兰大学心理学研究所,1053,匈牙利;10 莱特州立大学邦绍夫特医学院和代顿 VA 医学中心精神病学系,俄亥俄州代顿,45435,美国;11 佛蒙特大学精神病学系,佛蒙特州伯灵顿,05405,美国;12 肯尼斯·布鲁姆行为与神经遗传研究所营养基因组学部,德克萨斯州奥斯汀,78701,美国; 13 以色列阿里埃勒大学阿德尔森医学院分子生物学系
鼠标引物 - 基因名称
免疫系统是为了抵消不可预测的威胁,但它依靠可预测的活动周期来正常运行。免疫功能中的每日节奏是一个不断扩展的研究领域,许多人源自基于遗传的计时机制,称为昼夜节律。挑战是如何利用这些生物节奏来改善医疗干预措施。在这里,我们回顾了最近的文献,记录了昼夜节律如何组织基本的先天和适应性免疫活动,昼夜节律的免疫学后果和睡眠破坏以及该领域的知识差距。然后,我们考虑将昼夜节律与疫苗接种联系起来的证据,这是免疫功能的重要临床实现。最后,我们讨论了将昼夜节律免疫转换为患者床边的实用步骤。
上核(SCN)是人脑和身体的“主时钟”。对我们昼夜节律的最大外部影响是轻
通过单击工具栏中的图标,您可以查看通量的首选项。您可以移动滑块以设置屏幕的构图。您可以看到我始终将我的矿山设置为更黄。它知道我在凌晨6:30醒来,并假定我的就寝时间是晚上10:30。您可以看到,当我们接近邮政编码的日落时,它将改变我的屏幕的组成,甚至在过去的睡前时更加急剧。