XiaoMi-AI文件搜索系统
World File Search System抽象Zilurgisertib有效抑制ALK2信号通路...
引言:贫血在骨髓纤维化(MF)的患者中很常见,并且与红细胞输血的需求和临床预后不良有关。Janus激酶(JAK)抑制剂(如鲁唑替尼)被广泛用于治疗MF的症状并改善生活质量,但也广泛地是骨髓抑制。可以阻止JAK信号传导同时避免贫血的新治疗性干预措施,通过减少导致停用和/或次优剂量的不良副作用来使MF患者受益。最近的研究表明,抑制激活素A受体1(ACVR1)/激活素受体样激酶2(ALK2)是肝素转录调节上游的骨形态发生蛋白(BMP)受体,可以降低MF患者的血清HEPCIDIN水平,并改善MF的肝素水平。1,2降低肝素的水平,是调节铁稳态的关键激素,并恢复红细胞生成会使通过JAK抑制剂治疗的MF患者有益。 当前,批准或正在研究的几种ALK2抑制作用,包括Momelotinib(JAK1/JAK2和ALK2抑制剂)和Pacritinib(JAK2,Interleukin-1受体相关激酶1 [IRAK1]和ALK2抑制剂)。 Momelotinib和Pacritinib研究的最新临床数据表明,ALK2抑制可改善MF患者的贫血。 因此,我们寻求一种有效,有选择性的ALK2抑制剂,并且可以滴定。 在这里,我们讨论了Zilurgisertib,这是一种ALK2特异性抑制剂,可以滴定以满足患者需求。1,2降低肝素的水平,是调节铁稳态的关键激素,并恢复红细胞生成会使通过JAK抑制剂治疗的MF患者有益。当前,批准或正在研究的几种ALK2抑制作用,包括Momelotinib(JAK1/JAK2和ALK2抑制剂)和Pacritinib(JAK2,Interleukin-1受体相关激酶1 [IRAK1]和ALK2抑制剂)。Momelotinib和Pacritinib研究的最新临床数据表明,ALK2抑制可改善MF患者的贫血。因此,我们寻求一种有效,有选择性的ALK2抑制剂,并且可以滴定。在这里,我们讨论了Zilurgisertib,这是一种ALK2特异性抑制剂,可以滴定以满足患者需求。
针对嵌合G250的新型DNA疫苗可有效抑制体内肿瘤
摘要。– 目的:开发一种基于G250抗原的DNA疫苗进行肿瘤免疫治疗的有效方法,并研究其对肾细胞癌小鼠的抗肿瘤反应。材料与方法:通过PCR制备人、猴和小鼠的G250。通过整合三个物种的不同基因片段获得异源嵌合G250基因。然后将嵌合G250插入真核表达质粒pVAX1-IRES-GM/B7,获得可同时表达嵌合G250抗原和免疫佐剂的DNA疫苗(命名为pVAX1-tG250-GM/B7)。通过转染Cos7细胞,使用流式细胞术和免疫荧光分析检测嵌合G250抗原的表达。体内免疫应答及抗肿瘤保护作用评价。结果:经PCR及基因测序鉴定,重组质粒DNA疫苗构建成功,嵌合G250抗原在Cos7细胞中得到良好表达,ELISPOT及ELISA检测发现pVAX1-tG250-GM/B7能引起强烈的免疫应答,接种pVAX1-tG250-GM/B7、balb/c小鼠肿瘤抑制明显,且生存时间较对照组延长。结论:本实验结果表明,基于异源嵌合抗原的DNA疫苗能在体内产生有效的抗肿瘤作用,是一种很有前途的肿瘤免疫治疗策略。
通用 DNA 适体可有效抑制 Spike 蛋白/hACE2 相互作用
严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 使用其刺突蛋白通过人血管紧张素转换酶 2 (hACE2) 附着到宿主细胞上。可以通过设计一种可以阻断刺突蛋白和 hACE2 之间相互作用的抑制剂来阻止病毒感染。如图 1 所示,一个刺突蛋白三聚体包含三个刺突蛋白,每个刺突蛋白由亚基 S1 和 S2 组成。S1 由 S1A 和 S1B 组成(图 1A),其中 S1B 也称为受体结合域 (RBD),与 hACE2 建立直接相互作用。1 此外,S2 亚基在介导病毒膜与宿主细胞融合方面发挥作用。因此,病毒进入是通过一系列事件完成的,即 S1 与 hACE2 结合,然后触发 S2 将其构象改变为更稳定的融合后状态并允许病毒进入宿主细胞。 2–4 由于 S1 直接与 hACE2 相互作用,许多研究小组一直在积极致力于发现各种生物分子,如抗体 5–10 或适体 11–16,以有效阻断 S1 和 hACE2 之间的相互作用。
文章 | 作者:Henrik Bygbjerg 高压细水雾系统可有效抑制电动汽车内的火灾
易于改造 SEM-SAFE® 系统是现有停车场的理想解决方案,因为它可以轻松改造现有建筑。其细不锈钢水管甚至可以安装在空间狭小的地方,并且只需使用一个集中泵组(根据需要连接到水管或水箱,使用可选的备用泵组)即可覆盖具有数千个喷嘴的超大型装置。强大的集中泵组使您能够根据需要分阶段和按区域灵活地安装高压水雾系统,使您能够随着设施中电动汽车数量的增加而更新消防系统。
DLL3 靶向双特异性抗体与 PD-1 抑制剂联合使用可有效抑制小细胞肺癌生长
摘要背景小细胞肺癌 (SCLC) 占肺癌的 15%,这种恶性肿瘤的主要治疗方法是化疗和放疗。Delta-like 3 (DLL3) 是 SCLC 免疫治疗的一个有吸引力的靶点,因为它的表达高度局限于 SCLC,在正常成人组织中几乎不可见。在当前的研究中,我们旨在探索通过 T 细胞的参与对 DLL3 靶向 SCLC 免疫治疗的疗效。方法作为概念验证,我们构建了 DLL3 靶向双特异性抗体和嵌合抗原受体 (CAR) 修饰的 T 细胞。评估了这些治疗单独或与程序性死亡-1 (PD-1) 抑制抗体联合使用的体外和体内肿瘤抑制活性。结果体外研究表明,DLL3 双特异性抗体和 CAR-T 均能有效杀死 DLL3 阳性癌细胞,包括天然 SCLC 细胞系 H446、H196、H82 和强制过表达 DLL3 的人工 A431 细胞。异种移植小鼠模型的体内研究表明,双特异性抗体和 CAR-T 均能抑制肿瘤生长,而与 PD-1 抑制抗体的联合治疗可显著提高 DLL3 双特异性抗体的疗效,但不能提高 CAR-T 细胞的疗效。结论我们的结果表明,DLL3 靶向双特异性抗体加 PD-1 抑制可有效控制 SCLC 生长。
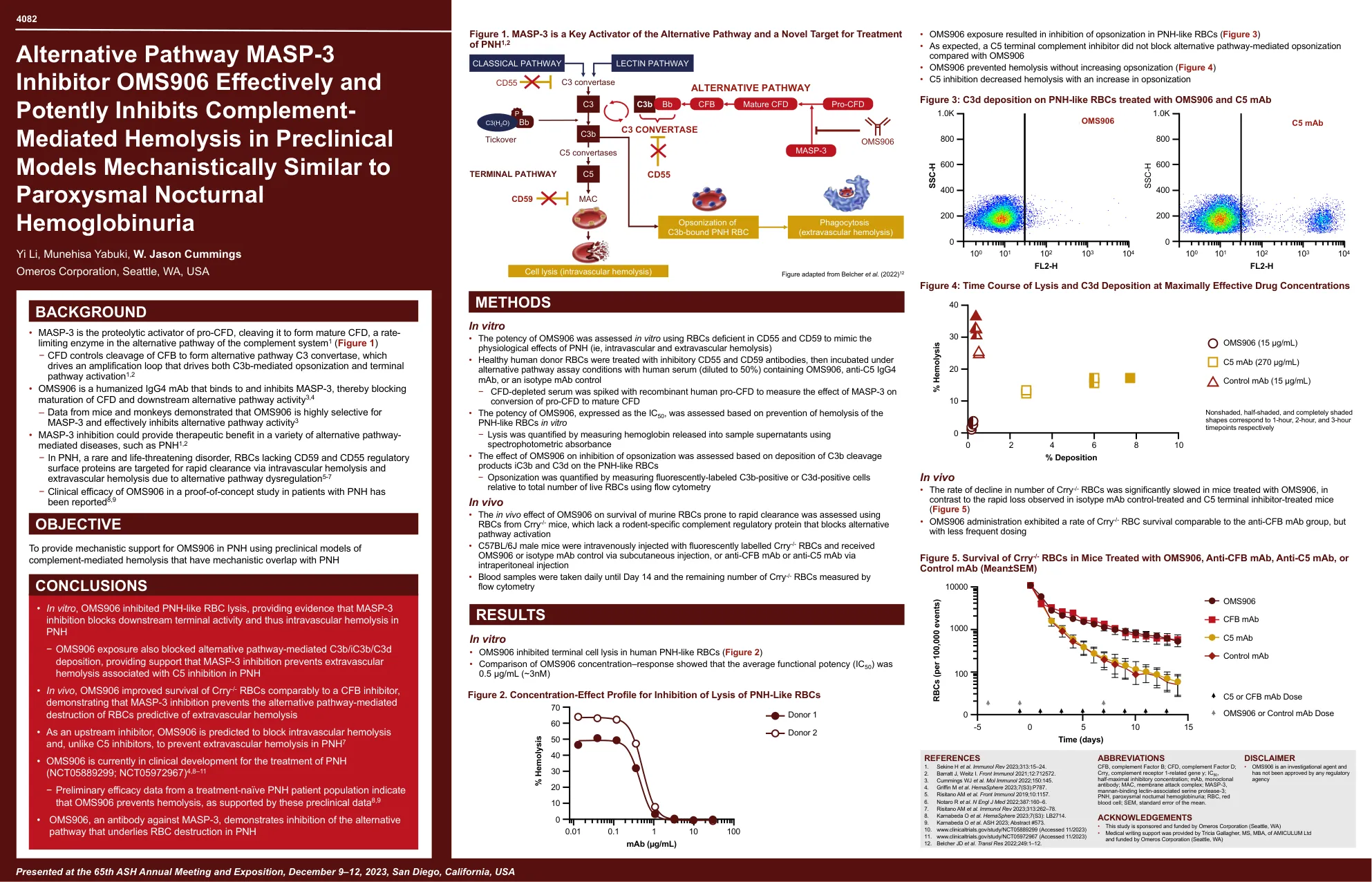
替代途径MASP-3抑制剂OMS906有效并有效抑制临床前模型中补体介导的溶血
在体外•使用CD55和CD59缺乏的RBC在体外评估OMS906的效力,以模仿PNH的生理效应(IE,血管内和血管外血液溶解)•健康的人类供体供体供体供体供应者RBC与抑制性CD55和CD59抗体的疾病相反,然后使用抑制性CD55和CD59抗体(CD59抗体)进行处理( containing OMS906, anti-C5 IgG4 mAb, or an isotype mAb control − CFD-depleted serum was spiked with recombinant human pro-CFD to measure the effect of MASP-3 on conversion of pro-CFD to mature CFD • The potency of OMS906, expressed as the IC 50 , was assessed based on prevention of hemolysis of the PNH-like RBCs in vitro − Lysis was quantified by measuring hemoglobin released into sample supernatants using spectrophotometric absorbance • The effect of OMS906 on inhibition of opsonization was assessed based on deposition of C3b cleavage products iC3b and C3d on the PNH-like RBCs − Opsonization was quantified by measuring fluorescently-labeled C3b-positive or C3d-positive cells relative使用体内流式细胞术的实时RBC总数•使用crry - / - 小鼠的RBC评估了OMS906对鼠rbcs易于快速清除的体内效应,该效应缺乏啮齿动物特异性补体调控蛋白,该蛋白质阻止了替代途径•C57BL/6J男性毛因菌株,•C57BL/6J男性毛因裂解 - / - RBCS并通过皮下注射接收OMS906或同种型MAB控制,或通过腹膜内注射抗CFB MAB或抗C5 MAB•每天采集血液样本,直到第14天,剩余的CRRY数量 - /-RBC通过流式网>> rbcs进行测量。
口服的小分子Bcl6抑制剂有效抑制弥散的大B细胞淋巴瘤细胞体外和体内生长
bcl6介导B细胞淋巴瘤细胞的存活率和细胞周期进程37。我们确定WK500B是否使用流式细胞术会影响DLBCL细胞周期的进程和细胞凋亡。结果(图3d,e)表明WK500B在S期诱导了明显的细胞周期停滞,并以2.5、5.0和10 µm的剂量引起剂量依赖性凋亡的诱导。阳性对照FX1不会在相同浓度下诱导细胞凋亡或细胞周期停滞(数据未显示)。总的来说,这些结果表明WK500B在体外诱导了DLBCL的死亡。3.4。WK500B表现出有利的药代动力学,并消除了体内生发中心的形成。
蛋白质脂质体介导的靶向乙酰胆碱酯酶基因递送用于有效的肝癌治疗
组分别为(0.25±0.12)G和(517.14±112.63)mm 3(图9 B,C)。自由疼痛的肿瘤抑制作用为7.81%,肿瘤生长抑制效率低下。然而,TF-PL/ACHE的肿瘤重量抑制率为77.47%,而GL/ACHE组的肿瘤抑制率仅为48.21%,TF- PL/ACHE有效抑制了肝癌细胞的生长并减轻了肿瘤的体重。这些结果支持体内TF-PL/ACHE治疗的上抗肿瘤功效。如图9 d所示,HE染色结果表明,在TF-PL/ACHE组肿瘤组织中,GL/ACHE和TF-PL/ACHE组中的肿瘤显示出温和的染色和大面积空白,显示了较大的坏死面积,因此肿瘤组织坏死非常严重。对照组的肿瘤组织和自由疼痛组较暗,显示出可识别的组织。总的来说,TF-PL/ACHE可以有效抑制肿瘤的生长。总的来说,TF-PL/ACHE可以有效抑制肿瘤的生长。
双内含子靶向 CRISPR-Cas9 介导的 AML RUNX1-RUNX1T1 融合基因破坏可在体内和体外有效抑制增殖并减小肿瘤体积
致癌融合驱动因子在血液癌症中很常见,因此是未来基于 CRISPR-Cas9 的治疗策略的相关靶点。然而,患者断点位置的变化对传统的断点靶向 CRISPR-Cas9 介导的破坏策略构成了挑战。在这里,我们提出了一种新的双内含子靶向 CRISPR-Cas9 治疗策略,用于靶向 5-10% 的新生急性髓系白血病 (AML) 中发现的 t(8;21),该策略可有效破坏融合基因,而无需事先确定断点位置。与非 t(8;21) AML 对照相比,在 RUNX1-RUNX1T1 双内含子靶向破坏后,AML t(8;21) Kasumi-1 细胞的体外生长率和增殖率分别降低了 69% 和 94%。此外,与对照组相比,注射了 RUNX1-RUNX1T1 破坏的 Kasumi-1 细胞的小鼠体内肿瘤生长减少了 69% 和 91%。这些发现证明了 RUNX1-RUNX1T1 破坏的可行性,在从被诊断为 AML t(8;21) 的患者身上分离的原代细胞中得到了证实。总之,我们证明了 AML t(8;21) 中双内含子靶向 CRISPR-Cas9 治疗策略的原理验证,而无需精确了解断点位置。
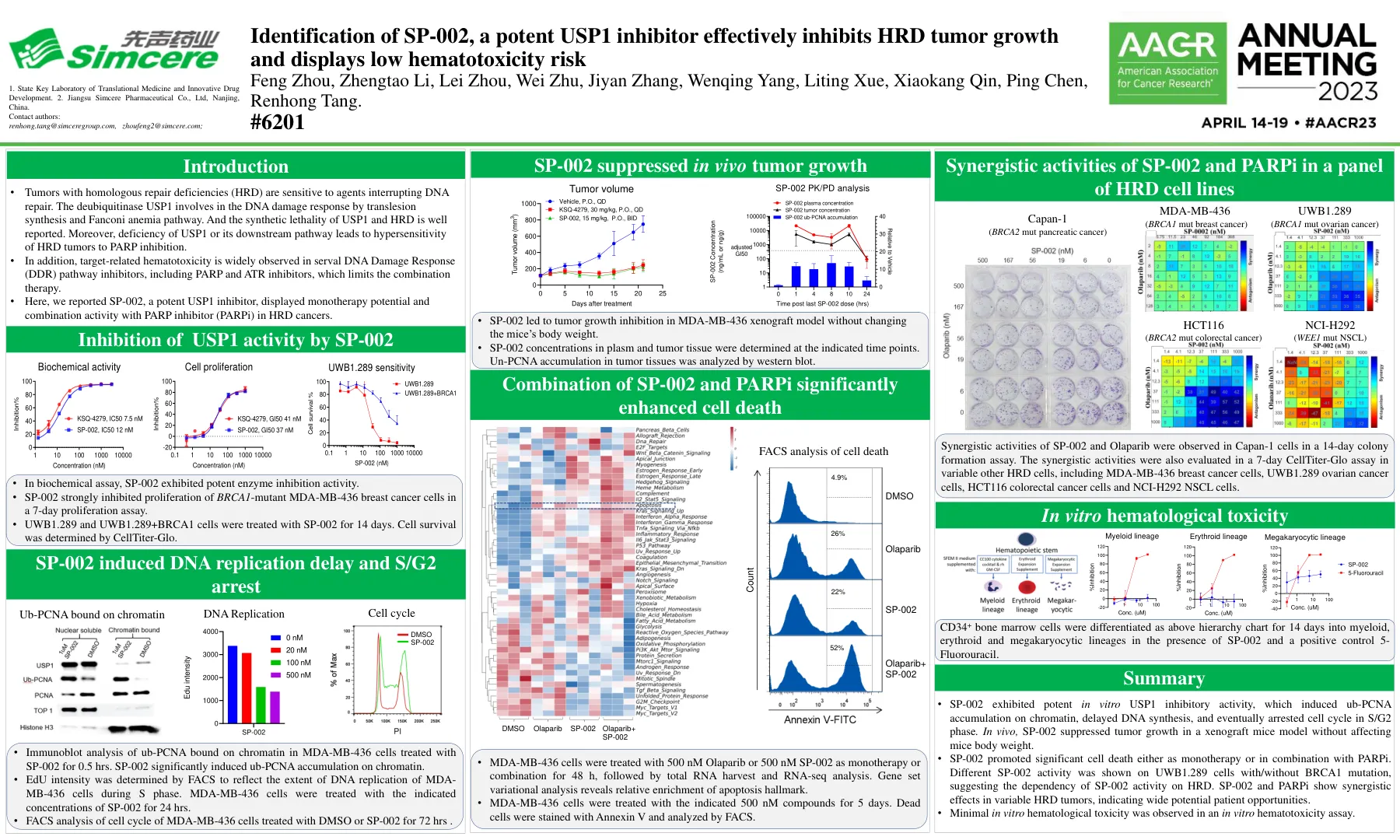
鉴定SP-002,有效的USP1抑制剂有效抑制HRD肿瘤的生长,并显示低血毒性风险风险王后,Zhengtao li,l
•具有同源修复缺陷(HRD)的肿瘤对中断DNA修复的药物敏感。去泛素酶USP1涉及Translesion合成和Fanconi贫血途径的DNA损伤反应。和USP1和HRD的合成致死性得到很好的报道。此外,USP1或其下游途径的缺乏会导致HRD肿瘤对PARP抑制过敏。•此外,与靶标相关的造血毒性被广泛观察到在包括PARP和ATR抑制剂在内的serval DNA损伤反应(DDR)途径抑制剂,这限制了联合疗法。•在这里,我们报道了SP-002是一种有效的USP1抑制剂,在HRD癌症中显示了与PARP抑制剂(PARPI)的单一疗法潜力和组合活性。