XiaoMi-AI文件搜索系统
World File Search SystemBoviShot ® 气雾防护 4
·有效抑制存在于所有牛体内并在应激时引发问题的巴氏杆菌和溶血性曼氏杆菌疫苗,预防呼吸道疾病 ·韩国唯一可预防 4 种犊牛呼吸道疾病的疫苗 ·同时预防 2 种疫苗和类毒素,提供强效免疫力
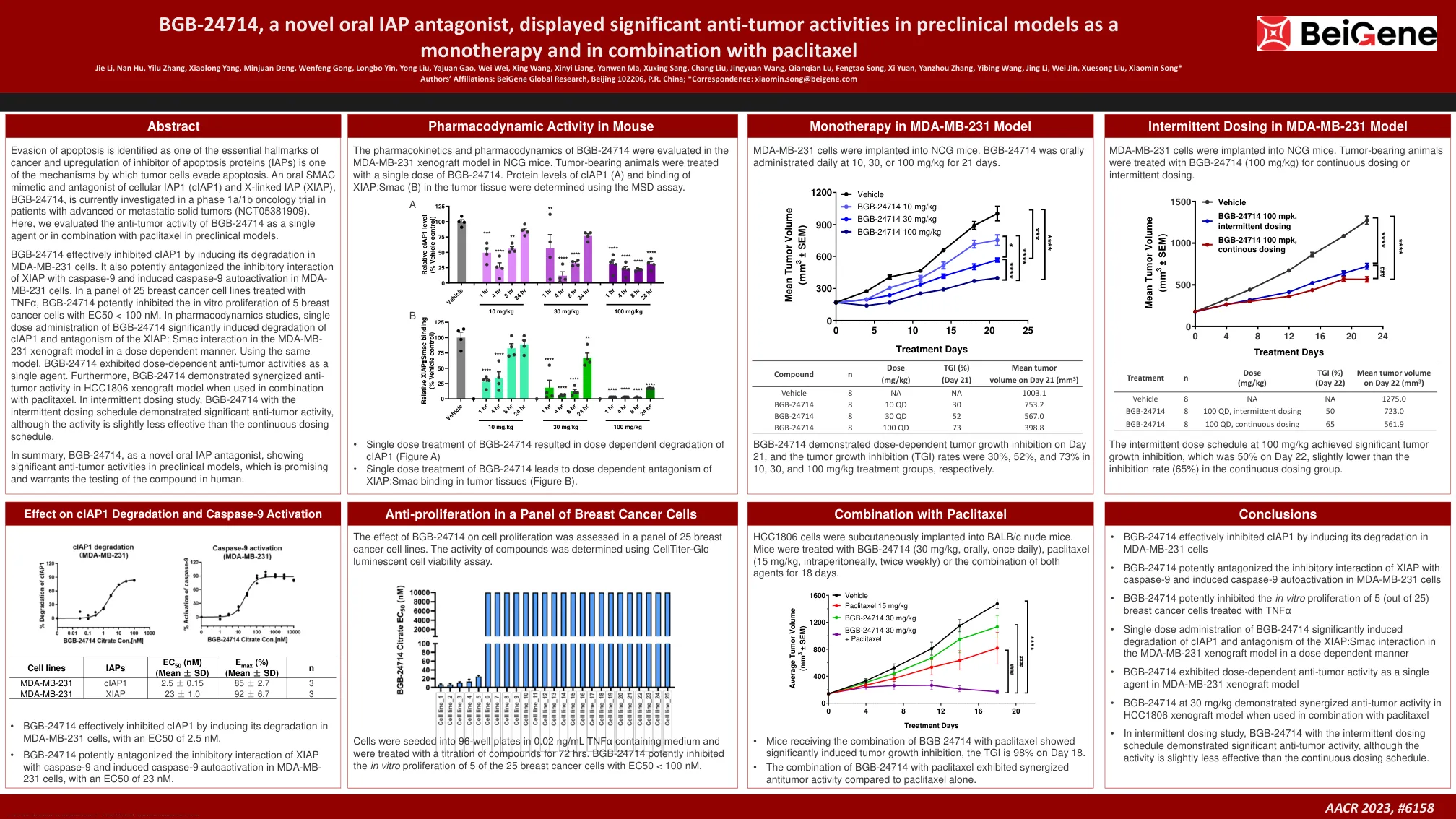
BGB-24714 是一种新型口服 IAP 拮抗剂,在临床前模型中表现出显著的抗肿瘤活性,
BGB-24714 可有效抑制 cIAP1,诱导其在 MDA-MB-231 细胞中的降解。它还可有效拮抗 XIAP 与 caspase-9 的抑制相互作用,并诱导 caspase-9 在 MDA-MB-231 细胞中的自激活。在用 TNFα 处理的 25 种乳腺癌细胞系中,BGB-24714 可有效抑制 5 种乳腺癌细胞的体外增殖,EC50 < 100 nM。在药效学研究中,单剂量施用 BGB-24714 可显著诱导 cIAP1 降解,并以剂量依赖性方式拮抗 MDA-MB-231 异种移植模型中的 XIAP:Smac 相互作用。使用相同模型,BGB-24714 作为单一药物表现出剂量依赖性抗肿瘤活性。此外,BGB-24714 与紫杉醇联合使用,在 HCC1806 异种移植模型中表现出协同抗肿瘤活性。在间歇给药研究中,BGB-24714 采用间歇给药方案表现出显著的抗肿瘤活性,尽管其活性略低于连续给药方案。
抑制Ni屏障层对10μM微圆中多孔Cu3SN生长的影响
相反,通过插入薄的Ni层,在SN焊料区域中观察到很少的Cu原子,如图4(c-d),这表明Ni层可以有效抑制Cu原子扩散。此外,Ni和Sn的反应速率比Cu和SN的反应速率慢[23,24],这表明Ni屏障层可以显着阻碍IMC的生长,它控制了多孔
固体抑制剂对氢气燃烧的影响
将氢用作能量载体是一种有前途的解决方案,可实现在全球能量混合物中增加使用可再生能源的过渡。然而,氢气混合物具有高反应性,用于爆炸保护的常规技术对氢系统的适用性有限。因此,与基于常规的碳氢化合物燃料相比,实现相同水平的氢能系统安全性并不是一件直接的。过去几十年来,开发了具有固体抑制剂的蒸气云爆炸的创新溶液,例如碳酸氢钠和碳酸钾(Roosendans and Hoorelbeke,2019年)。与镜头相比,这两种物质都是无毒的,不可燃料的,低成本的,对环境的无害。尽管固体抑制剂对碳氢化合物可能非常有效(Babushok和Tsang,2000),但实验表明,相同的化合物对于抑制氢气混合物的抑制不是很有效。缺少碳意味着氢燃烧与碳氢化合物固有不同,但是,碳氢化合物的燃烧包括涉及氢气混合物燃烧的基本反应。当暴露于钠或钾化合物(Roosendans,2018年)时,这些基本反应发生了变化。基于这些基本反应的化学动力学模拟表明,钾化合物应大大降低火焰速度。 因此,需要更多的抑制剂来有效抑制预混合的氢气火焰。表明,钾化合物应大大降低火焰速度。因此,需要更多的抑制剂来有效抑制预混合的氢气火焰。与烃燃烧相比,相同的模拟显示自由基的产生明显更高。为了使固体抑制剂有效,该化合物必须在火焰区中蒸发,并且该过程似乎是有效抑制氢爆炸的主要障碍。本文提出了由化学动力学软件的专用实验和仿真介绍的,这些软件详细介绍了先前的发现,并提高了对氢气燃烧中固体抑制剂的基本力学的理解。
癌症免疫和癌症免疫疗法
增加和抗癌作用并不能诱导抗癌作用,而由于野生IL-2和IL-2受体β /γ链中的结合力弱结合力而被操纵以与α链结合的粘合剂有效抑制CD8 T细胞和肿瘤的生长。使用抗PD-1靶抗体治疗时,还显示出改善的肿瘤生长抑制。- 特别是,CD8 T细胞同时表达IL-2受体α-链CD25和PD-1
肿瘤免疫检查点PD-1/PD-L1抑制剂的中药活性成分研究进展
表没食子茶素没食子酸酯 (EGCG) ,是茶多酚 中最有效的活性成分,属于儿茶素类化合物。 EGCG 具有抗菌、抗炎、抗病毒、抗肿瘤等作用 [ 21 ] 。有研 究报道,在非小细胞肺癌中, EGCG 能够抑制 IFN- γ 和表皮生长因子( EGF )诱导的 PD-L1 的表达。 EGCG 和绿茶提取物能够抑制 A549 人肺癌细胞 中 JAK2/STAT1 信号通路,从而减少由 IFN-γ 诱导 的 PD-L1 mRNA 以及蛋白质的表达水平;同时通 过抑制 EGF 受体 /AKT 信号通路,使 EGF 诱导的 PD-L1 的表达降低。在腹腔注射 4- 甲基亚硝胺基 - 1- ( 3- 吡啶基) -1- 丁酮 (NNK) 诱导的小鼠肺癌模型 中,小鼠的饮用水中加入 0.3% 的绿茶提取物,可以 降低每只小鼠的平均肿瘤数目和 70% PD-L1 的阳 性细胞率。在 F10-OVA 黑色瘤细胞和肿瘤特异 性 CD3+T 细胞共培养模型中, EGCG 能够使 F10- OVA 细胞的 PD-L1 mRNA 的表达降低,并且可以 恢复肿瘤特异性 CD3+T 细胞 IL-2 mRNA 的表 达 [ 22 ] 。这些结果表明, EGCG 是 PD-L1 的有效抑制 剂,具有抑制 EGFR/Akt 和 IFNR/JAK2/STAT1 通 路的潜力。
阻断 SHP2 与 PD-1 之间的相互作用为开发 PD-1 抑制剂带来了新机遇
目前的免疫肿瘤学临床缺乏小分子 PD-1 抑制剂。目前批准用于临床的 PD-1/PD-L 1 抗体抑制剂可阻断 PD-L 1 和 PD-1 之间的相互作用,从而增强 CD 8 + 细胞毒性 T 淋巴细胞 (CTL) 的细胞毒性。是否可以针对 PD-1 信号通路上的其他步骤还有待确定。在这里,我们报告亚甲蓝 (MB),一种 FDA 批准用于治疗高铁血红蛋白血症的化学药品,可有效抑制 PD-1 信号传导。MB 增强了 PD-1 抑制的 CTL 的细胞毒性、活化、细胞增殖和细胞因子分泌活性。从机制上讲,MB 阻断了人类 PD-1 的 Y 248 磷酸化免疫受体酪氨酸转换基序 (ITSM) 与 SHP 2 之间的相互作用。 MB 使激活的 CTL 能够缩小转基因小鼠模型中表达 PD-L 1 的肿瘤异体移植和原发性肺癌。MB 还能有效抵消从健康供体外周血中分离的人类 T 细胞上的 PD-1 信号传导。因此,我们确定了一种 FDA 批准的能够有效抑制 PD-1 功能的化学物质。同样重要的是,我们的工作为开发针对 PD-1 信号传导轴的抑制剂的新策略提供了启示。
Honokiol抑制SKBR3细胞的生长 零星甲状腺癌的进展中的更新:从分子到诊所 在治疗晚结直肠癌治疗中的基于Pemetrexed的化学疗法 胃食管癌的靶向疗法 使用支撑矢量机和卷积神经网络评估脑低度神经胶质瘤中磁共振图像分割 肺癌中的恶性胸腔积液:专注于治疗 靶向边缘区淋巴瘤中的致病机制:概念和超越
honokiol是一种从中草药木兰中分离出的生物活性成分,可以有效抑制肿瘤细胞的生长。根据文献,Honokiol可以诱导胰腺癌和胃癌细胞的凋亡(4,5),并且还可以抑制黑色素瘤的生长和转移(6)。当前的乳腺癌研究仅限于Honokiol对两个人表皮生长因子受体2(HER2)阴性细胞系MDA-MB-231和MCF-7(7,8)的影响。Honokiol在乳腺癌SK-BR-3细胞中的作用和机制尚未报道。SK-BR-3细胞,它是上皮细胞的粘附细胞。作为具有里程碑意义的乳腺癌细胞,SK-BR-3细胞在许多研究中已被用作实验对象(9-11)。SK-BR-3细胞是具有高HER2表达的乳腺癌细胞。HER2阳性乳腺癌的复发和转移率很高,预后不良(12)。 发现可以有效抑制SK-BR-3细胞生长的抗肿瘤药物对于治疗乳腺癌很重要。 因此,在本研究中,我们使用不同浓度的HONOKIOR治疗乳腺癌SK-BR-3细胞,以观察其对SK-BR-3细胞的增殖,凋亡,侵袭和迁移的影响,并检测WNT信号传导途径相关蛋白质β-Catenin和c-Myc中WNT信号传导途径中表达的变化。 这可以提供新的证据,表明Honokiol可以用作有效治疗乳腺癌的抗肿瘤药物。HER2阳性乳腺癌的复发和转移率很高,预后不良(12)。发现可以有效抑制SK-BR-3细胞生长的抗肿瘤药物对于治疗乳腺癌很重要。因此,在本研究中,我们使用不同浓度的HONOKIOR治疗乳腺癌SK-BR-3细胞,以观察其对SK-BR-3细胞的增殖,凋亡,侵袭和迁移的影响,并检测WNT信号传导途径相关蛋白质β-Catenin和c-Myc中WNT信号传导途径中表达的变化。这可以提供新的证据,表明Honokiol可以用作有效治疗乳腺癌的抗肿瘤药物。我们根据MDAR报告清单介绍以下文章(可在http://dx.doi.org/10.21037/tcr-20-3110中找到)。
Electrochimica acta
锌 - 碘流量电池(ZIFB)在过去几年中正在研究,因为它是作为未来电化学能源存储的潜在候选人的适用性。在骑自行车期间,影响ZIFB可靠性的最大挑战之一是通过膜的大量水迁移,因为驱虫剂和天主解中的摩尔浓度差异,这会使每个隔间中的渗透压失衡。考虑到质量平衡,我们建议通过将额外的溶质添加到下离子浓度的隔室中,以使电解质的总离子浓度均衡,以限制水交叉。通过评估循环后电解质和半细胞电荷电解质的实验验证,对该电解质浓度平衡策略进行了平衡策略,这证实了有效抑制从天主教徒到Anolyte的水迁移的有效抑制。此外,通过Nafion 117对离子和水传输机理进行深入分析,证实与溶剂化的Zn 2 +离子相比,离子半径的溶剂化的K +离子是主要的迁移载体。因此,添加额外的Ki溶质有益于抑制大型水合Zn 2 +离子的主要运输以及较高的水。最后,在与平衡摩尔浓度的电解质组装的细胞中提高的电导率,放电能力和电压效率提高的改进的ZIFB细胞行为结论是我们目前的研究结论,证明了将电解质浓度调整为抑制水作为一种有吸引力的方法的有效方法。
传染病中的中枢神经系统药物研发
• RMC-6236 有效抑制 RAS(ON) 的所有亚型,包括致癌 KRAS、NRAS 和 HRAS 突变体以及野生型 RAS • 使用 (环丝氨酸蛋白酶 A)-RAS 胶合机制是这种广泛 RAS 信号阻断的基础 • 临床前研究显示,RMC-6236 在 842 种 RAS 驱动的细胞系中表现出广谱活性,这转化为 NSCLC、CRC 和 PDAC 的多种异种移植模型中的消退 • 初步临床数据显示,由先前“无法用药”的 RAS 突变驱动的肿瘤出现显著消退