XiaoMi-AI文件搜索系统
World File Search System依赖于极化的效果在2D有限尺寸的吸附岛上对电介质底物的振动吸收光谱
相比之下,IRRAS在氧化物和二元组中的应用通常不那么发达了。虽然广泛可用的氧化物粉末吸附剂的实验性IR数据,但这些材料的宏观单晶的10,11 IRRAS数据受到限制。10–13此限制源于电介质的特定光学特性,并阻碍了直到最近氧化物上IRRAS数据的实验记录。金属和半导体之间的关键区别是通过金属电子对电场进行筛选,影响总红外反射率,并引起所谓的表面选择规则,管理金属表面上的IRRAS。2,14该规则规定,对于金属,通常仅具有过渡偶极矩的成分的振动
种间种间 - 奇数机的视觉,具有极化的实时导航和反脱落模式识别
尖端的人形机器视觉仅模仿人体系统,并且缺乏传达导航和真实图像信息的偏光功能。种间 - 奇数视觉保留多个主机的能力将导致高级机器视觉。但是,在一个选择性设备中实现多种物种(人类和非人类)的视觉功能仍然难以捉摸。在这里,我们基于Van der waals异质结构(RES 2 / GESE 2)开发了光学控制的偏光晶体。该设备同时提供了极化灵敏度,不易旋转性和正位/负光电传感。极化测量值可以识别像蜜蜂一样实时导航的天体极化。同时,通过感应,记忆和突触功能,可以像人类一样完成认知任务。尤其是,与传统的类人动物对应物相比,极化法的抗眩光识别可节省数量级的能量。该技术促进了种间 - 奇数视觉系统的概念,该系统将利用自动车辆,医疗诊断,智能机器人技术等的进步。
独立于极化的空心纳米型元面积,具有坚固的准准结合状态
,一个光子工程小组,桑坦德大学,39005,西班牙B Ciber debioingeniería,生物群岛,Y纳米甲基甲虫,萨鲁德·卡洛斯III,马德里,28029,西班牙西班牙C c Instition de InvestiTo deResjuctivaciónHealthHealth Valinevalinevalain valenticala(Idialla),39011。帕拉联邦大学工程系,邮政信箱8619,阿肯西亚UFPA,贝莱姆,66075-900,巴西和电气与计算机工程学院,坎普纳斯大学坎皮纳斯大学,坎皮纳斯大学,13083-852,巴西坎皮纳斯大学,巴西f电气与信息工程系Sannio,Benevento,82100,意大利H国家研究委员会,微电子和微系统研究所,通过Del Fosso del Cavaliere 100,罗马,00133,意大利,一个光子工程小组,桑坦德大学,39005,西班牙B Ciber debioingeniería,生物群岛,Y纳米甲基甲虫,萨鲁德·卡洛斯III,马德里,28029,西班牙西班牙C c Instition de InvestiTo deResjuctivaciónHealthHealth Valinevalinevalain valenticala(Idialla),39011。帕拉联邦大学工程系,邮政信箱8619,阿肯西亚UFPA,贝莱姆,66075-900,巴西和电气与计算机工程学院,坎普纳斯大学坎皮纳斯大学,坎皮纳斯大学,13083-852,巴西坎皮纳斯大学,巴西f电气与信息工程系Sannio,Benevento,82100,意大利H国家研究委员会,微电子和微系统研究所,通过Del Fosso del Cavaliere 100,罗马,00133,意大利,一个光子工程小组,桑坦德大学,39005,西班牙B Ciber debioingeniería,生物群岛,Y纳米甲基甲虫,萨鲁德·卡洛斯III,马德里,28029,西班牙西班牙C c Instition de InvestiTo deResjuctivaciónHealthHealth Valinevalinevalain valenticala(Idialla),39011。帕拉联邦大学工程系,邮政信箱8619,阿肯西亚UFPA,贝莱姆,66075-900,巴西和电气与计算机工程学院,坎普纳斯大学坎皮纳斯大学,坎皮纳斯大学,13083-852,巴西坎皮纳斯大学,巴西f电气与信息工程系Sannio,Benevento,82100,意大利H国家研究委员会,微电子和微系统研究所,通过Del Fosso del Cavaliere 100,罗马,00133,意大利
外部人体心室中复极化替代品超出复极化的高级动力学独立于恢复特性
此预印本版的版权持有人于2023年8月21日发布。 https://doi.org/10.1101/2023.08.16.23293853 doi:medrxiv preprint
材料光子学
摘要:综合硅光子学中的极化依赖性对量子技术的量子状态的操纵有害影响。这些限制对进一步的技术发展具有深远的影响,尤其是在量子光子互联网中。在这里,我们提出了一个基于340 nm厚的硅在绝缘子(SOI)平台上的独立于极化的马赫 - Zehnder干涉仪(MZI)结构。MZI促进了低损失,宽阔的操作带宽以及对制造不完美的宽敞耐受性。,对于横向电动(TE)和横向磁性(TM)模式,我们在100 nm带宽(1500 〜1600 nm)中实现了<10%的过剩损失,> 18 dB的灭绝无线电的灭绝无线电损失。我们在数值上证明了在1550 nm处两个极化的干扰可见性为99%,独立于极化的损失(PDL)为0.03 dB。此外,通过使用相补偿和自我形象的原理,我们将波导锥度的长度缩短了几乎一个数量级,而TE和TM极化的传输均达到95%。到目前为止,所提出的结构可以显着改善整合并促进整体式综合量子互联网的发展。
使用3D多孔结构的超级电容器的开发
具有空间变化的极化模式的近端光束是结构化光领域的许多最新发展[1-4]。这种结构化的梁可以复杂,许多空间模式都促成了复杂的极化模式[5-7]。最简单的是,它们可能是由具有正交极化的两种不同的空间模式形成的。基本示例是具有径向或方位角极化的光束[8-10]。前者是在传播方向上实现紧密的聚焦和增强的田间强度[11,12]。我们在2020年表明,最简单的vecter梁可以表现出偏振模式,该模式很容易用天空结构鉴定[13]。此类模式的特征是
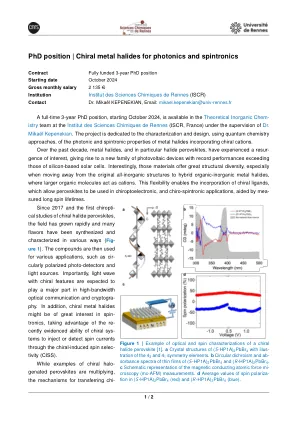
光子和旋转的手性金属卤化物
图1 |手性卤化物钙钛矿的光学和自旋表征的示例[1]。(S -HP1A)2 PBBR 4的晶体结构,具有4 3和4 1对称元素的插图。b(S -HP1A)2 PBBR 4和(R -HP1A)2 PBBR 4的薄膜的圆形二色性和 - s斑谱光谱。C磁性原子力M- croscopy(MC-AFM)测量的示意图。 d在(S -HP1A)2 Pbbr 4(红色)和(R -HP1A)2 PBBR 4(蓝色)中的自旋极化的平均值。C磁性原子力M- croscopy(MC-AFM)测量的示意图。d在(S -HP1A)2 Pbbr 4(红色)和(R -HP1A)2 PBBR 4(蓝色)中的自旋极化的平均值。