XiaoMi-AI文件搜索系统
World File Search SystemEris-投资者-演示文稿-2024 年 9 月 30 日.pdf
• 推出 OSD 出口业务 - Eris AMD 工厂正在等待欧盟 - 第四季度的 GMP 和 ANVISA 检查 • 推出 EU-CDMO(注射剂)业务 • 目标受众 - 欧洲大型制药公司和大型仿制药公司 • 商业模式 - 在欧盟销售的 3 - 5 年制造合同 - 高客户粘性和较低的价格敏感度 • 我们的价值主张 - “唯一一家获得欧盟批准的拥有全套注射剂型的印度注射剂企业”
第1页,共2612页pembrolizumab,带紫杉醇和卡铂,然后是半柔拜蛋白和环磷酰胺(pembro/pc-ec)
紫杉醇和卡铂(PC)通过细管(插管)作为静脉(静脉注射)在1小时内作为输液(滴水)(滴水)(豆蔻素)和30分钟(碳纤维素)(碳蛋白)(碳蛋白),并在21天(12周)的第1、8和15天(12周)(12周)。,然后是半柔软蛋白和环磷酰胺(EC),它们通过细管(插管)作为注射剂(静脉注射)作为注射剂,每21天通过快速流动的输注(滴水)将其送入4个周期(12周)。
Wafermine和IXB 401新加坡,2024年9月16日
GLP-1受体激动剂 Semaglutide在管理2型糖尿病和肥胖症方面表现出了显着的功效。 GLP-1药物市场被GlobalData预测,到本十年末,在强劲的需求驱动到十年末。 但是,现有的治疗方案,例如注射剂和口服半卢比,患者偏好的面部限制以及生物利用度和可变性。 此外,对注射GLP-1药物的需求不断增长,超越了供应量,而这些注射剂的产量增加会带来环境挑战。 IXB 401提供了一种新颖的解决方案,可以解决这些问题,同时增强患者合规性并减少环境影响。Semaglutide在管理2型糖尿病和肥胖症方面表现出了显着的功效。GLP-1药物市场被GlobalData预测,到本十年末,在强劲的需求驱动到十年末。但是,现有的治疗方案,例如注射剂和口服半卢比,患者偏好的面部限制以及生物利用度和可变性。此外,对注射GLP-1药物的需求不断增长,超越了供应量,而这些注射剂的产量增加会带来环境挑战。IXB 401提供了一种新颖的解决方案,可以解决这些问题,同时增强患者合规性并减少环境影响。IXB 401提供了一种新颖的解决方案,可以解决这些问题,同时增强患者合规性并减少环境影响。
atogepant(qulipta)事先授权请求表格
13。患者是否有禁忌症,不耐受性或失败了以下至少一个可注射剂的2个月试验:Erenumab-aooe(Aimovig)(Aimovig),Fremanezumab-vfrm(Ajovy),Galcanezumab-gnlm(emgality)?
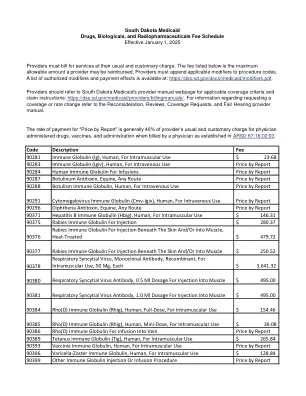
代码 描述 费用 90281 免疫球蛋白 (Ig),人类...
注射剂,钆基磁共振造影剂,未另行指定(编号),每毫升 1.48 美元 A9580 氟化钠 F-18,诊断用,每研究剂量,最高 30 毫居里 按报告定价 A9581 注射剂,钆塞酸二钠,1 毫升 14.70 美元 A9583 注射剂,钆磷维赛特三钠,1 毫升 按报告定价 A9584 碘 1-123 碘氟烷,诊断用,每研究剂量,最高 5 毫居里 2,756.29 美元 A9585 注射剂,钆布醇,0.1 毫升 0.28 美元 A9586 Florbetapir F18,诊断用,每研究剂量,最高 10 毫居里 2,931.70 美元 A9587 镓Ga-68,Dotatate,诊断,0.1 毫居里 $ 57.01 A9588 Fluciclovine F-18,诊断,1 毫居里 $ 507.08 A9589 滴注,六氨基乙酰丙酸盐盐酸盐,100 毫克 $ 1,378.71 A9590 碘 I-131,Iobenguane,1 毫居里 价格报告 A9591 氟雌二醇 F 18,诊断,1 毫居里 $ 752.40 A9592 铜 Cu-64,Dotatate,诊断,1 毫居里 $ 987.53 A9593 镓 Ga-68 Psma-11,诊断,(Ucsf),1 毫居里 价格报告 A9594 镓 Ga-68 Psma-11,诊断,(Ucla),1毫居里价格报告 A9595 Piflufolastat F-18,诊断,1 毫居里 $ 595.39 A9596 镓 Ga-68 Gozetotide,诊断,(Illuccix),1 毫居里 $ 1,009.58
昆士兰州阿米卡星治疗耐药结核病和非结核分枝杆菌感染的使用指南
尽管世界卫生组织 (WHO) 最近发布的关于耐多药结核病 (MDR-TB) 治疗的最新信息建议优先使用贝达喹啉、氟喹诺酮类、利奈唑胺、氯法齐明和环丝氨酸等口服药物,但二线注射药物阿米卡星仍有其作用。世卫组织最近的一份技术报告呼吁进一步研究注射剂对治疗 MDR-TB 的价值。1 世卫组织于 2019 年 12 月迅速通报建议在较短的 MDR-TB 方案中优先使用贝达喹啉而不是阿米卡星(或其他注射剂),注射剂的作用进一步减弱。尽管如此,阿米卡星仍然是较短的 MDR-TB 方案的潜在组成部分,也是在不能使用首选口服药物的较长的 MDR-TB 方案的一部分。2 分离株必须证明对阿米卡星易感,并在可以充分监测毒性的情况下给药。阿米卡星可能有一定益处,这可以归因于其杀菌作用和弱的体外杀菌特性。
更健康。触手可及。日复一日。
我们继续投资以提高产能,在葡萄牙和新泽西增加了新的高速生产线,阿尔及利亚和摩洛哥的新注射剂工厂也正在建设中。我们拥有新的研发领导结构,专注于为我们的产品组合添加更复杂的产品。我们正在美国建立新的无菌复合业务,虽然目前还处于起步阶段,但随着我们成为该市场领先的复合剂制造商,这项业务将成为未来 Hikma 的重要贡献者。我们继续在中东和北非注射剂业务方面取得良好的战略进展。2022 年,我们与 Celltrion Healthcare 和君实生物签署了新的生物仿制药和生物制品许可协议。最后,我们继续在欧洲扩张,进入法国和加拿大。我们预计这些市场将成为未来几年的重要增长动力。
药品短缺:预防和缓解药品短缺的政策建议概况评估
在过去二十年中,处方药短缺一直是美国广泛产品(包括化疗、抗生素和麻醉药)的长期问题。美国食品药品管理局 (FDA) 认为,当一种医疗产品的总市售供应量无法满足当前需求时,就会出现药物短缺。1 据 FDA 称,药物短缺在 2011 年达到顶峰,有超过 250 种新药短缺。尽管 FDA 与制造商成功合作,避免了 2022 年出现 222 种短缺,但短缺问题仍然存在,当年报告了 49 种新短缺药物。2 FDA 报告称,目前有 138 种药物短缺,尽管 FDA 的统计可能与其他来源的统计不同,这取决于它们的统计方式(例如,是否计算分配或缺货的药物)。药物短缺可能遍及整个处方药市场,包括品牌药物、仿制药、新产品和成熟产品。但是,有些产品比其他产品更容易出现短缺。例如,老药、商品化药和仿制药以及生产工艺复杂的无菌注射剂极易出现短缺。3 在 FDA 对短缺药品的研究中,67% 是具有仿制药的药品,63% 是无菌注射剂。4 同样,IQVIA 最近的一份报告指出,过去 6 年短缺的药品中有 84% 是仿制药,67% 是注射剂。5 人们普遍认为,以下根本原因导致了药品短缺: