XiaoMi-AI文件搜索系统
World File Search SystemPIP 合作伙伴贡献(2012 - 2024)
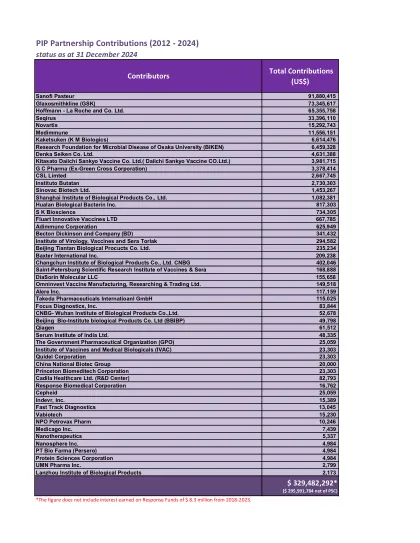
赛诺菲巴斯德 91,880,415 葛兰素史克(GSK) 73,345,617 霍夫曼-罗氏公司 65,355,758 Seqirus 33,396,110 诺华 15,292,743 Medimmune 11,556,151 Kaketsuken(KM Biologics) 6,614,476 大阪大学微生物疾病研究基金会(BIKEN) 6,459,328 Denka Seiken Co. Ltd. 4,631,388 北里第一三共疫苗有限公司(Daiichi Sankyo Vaccine CO.Ltd.) 3,981,715 GC Pharma(前绿十字公司) 3,378,414 CSL Limted 2,667,745布塔坦研究所 2,730,303 科兴生物制品有限公司 1,453,267 上海生物制品研究所有限公司 1,082,381 华兰生物疫苗股份有限公司 817,303 SK Bioscience 734,305 Fluart Innovative Vaccines LTD 667,785 Adimmune Corporation 625,949 Becton Dickinson and Company (BD) 341,432 病毒、疫苗和血清研究所 Torlak 294,582 北京天坛生物制品股份有限公司 235,234 百特国际公司 209,238 长春生物制品研究所有限公司 CNBG 402,046 圣彼得堡疫苗和血清科学研究所 168,888 DiaSorin Molecular LLC 155,658 Omninvest Vaccine Manufacturing, Researching & Trading Ltd. 149,518 Alere Inc. 117,159 Takeda Pharmaceuticals Internatioanl GmbH 115,025 Focus Diagnostics, Inc. 83,844 CNBG-武汉生物制品研究所有限公司52,678 北京生物研究所生物制品有限公司(BBIBP) 49,798 Qiagen 61,512 印度血清研究所有限公司 48,335 政府制药组织(GPO) 25,059 印度疫苗和医学生物制品研究所(IVAC) 23,303 Quidel Corporation 23,303 中国生物技术集团 20,000 Princeton Biomeditech Corporation 23,303 卡迪拉医疗保健有限公司(研发中心) 82,793 Response Biomedical Corporation 16,762 Cepheid 25,059 Indevr, Inc. 15,389 Fast Track Diagnostics 13,045 Vabiotech 15,230 NPO Petrovax Pharm 10,246 Medicago Inc. 7,439 Nanotherapeutics 5,337 Nanosphere Inc. 4,984 PT Bio Farma (Persero) 4,984 Protein Sciences Corporation 4,984 UMN Pharma Inc. 2,799 兰州生物制品研究所 2,173
用于输送药品和生物制品的设备的基本药物输送输出,行业指南草案
本指南涉及器械 1 和 17 组合产品 2,3 的药物输送性能信息的关键方面,这些产品包括器械组成部分 4,旨在输送人体药物,包括生物产品 5(本文称为药物输送器械)。 6 本指南描述了 FDA 与建立和评估药物输送性能所必需的器械设计输出相关的建议。该指南包括 21 在研究、营销和上市后变更申请中提交的信息和数据的建议。 7 一般而言,如本指南进一步讨论的那样,基本药物输送输出 (EDDO) 是指确保药物输送功能所必需的器械药物输送设计输出。 8 本指南建议了一种识别 EDDO 的方法,提供了特定类型器械的 EDDO 示例,并描述了申请中提供的与 EDDO 相关的信息和数据。 27
真实世界证据:关于药品和生物制品非干预性研究的考虑 行业指南
指导草案 本指导文件仅供评论之用。有关本草案的评论和建议应在《联邦公报》上公布指导草案发布通知后 90 天内提交。请将电子评论提交至 https://www.regulations.gov。请将书面评论提交至食品药品管理局卷宗管理人员(HFA-305),地址:5630 Fishers Lane, Rm. 1061, Rockville, MD 20852。所有评论均应注明《联邦公报》上公布的发布通知中所列的卷宗编号。 如对本草案有任何疑问,请联系 (CDER) Tala Fakhouri,电话:301-837-7407,或 (CBER) 沟通、推广和发展办公室,电话:800-835-4709 或 240-402-8010。
疫苗和相关生物制品咨询委员会 2024 年 6 月 5 日会议简报文件 - FDA
Moderna 生产的 Spikevax(COVID-19 疫苗,mRNA)获准用于主动免疫,以预防 12 岁及以上人群中由严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 引起的 2019 年冠状病毒病 (COVID-19)。Spikevax 含有核苷修饰的信使 RNA (mRNA),编码 Omicron 亚系 XBB.1.5 SARS-CoV-2 毒株的融合前稳定全长 Spike (S) 蛋白,封装在脂质颗粒中。 Moderna COVID-19 疫苗(2023-2024 配方)是一种使用与 Spikevax 相同工艺生产的疫苗配方,目前已获得 EUA 授权,可对 5 岁及以上的个人进行单剂量给药,对 6 个月至 4 岁未接种过 COVID-19 疫苗的个人进行两剂量给药,对 6 个月至 4 岁之前接种过 Moderna COVID-19 疫苗的个人进行单剂量给药。6 个月至 11 岁及以上患有某些免疫功能低下的人可以接受额外适合年龄的剂量。有关剂量和时间表的更多信息,请参阅 Moderna COVID-19 疫苗(2023-2024 配方)情况说明书。支持批准 Spikevax 和授权 Moderna COVID-19 的安全性和有效性数据
FDA 工作人员在人类药品和生物制品上市后安全监测方面的最佳实践
• 一种药品和生物制品安全管理的多学科、生命周期方法 • 告知系统性药品和生物制品安全监测频率和程度的一般考虑因素(第 4 节) • 基于特定产品类型和患者群体的其他考虑因素(第 5 节) • 基于对不良事件 (AE) 报告系统和其他数据源的筛选和数据挖掘的安全信号识别,包括对这些数据源进行筛选的频率和程度的一般做法,以及对已识别的信号进行优先排序(第 6 节) • 对已识别的安全信号进行多学科、全面的评估,整合从所有可用来源收集的累积数据(第 7 节) • 对产品和已识别的 AE 之间的因果关系的评估(第 8 节) • 针对已识别的安全信号可采取的监管和其他行动的概述(第 9 节)
第 4 季度 - 2023 年 Frederick Varricchio 博士、医学博士
美国食品药品管理局的生物制品评估与研究中心 (CBER) 制定了生物制品有效性与安全性 (BEST) 计划,以确保生物制品的安全性和有效性。BEST 使用人工智能和自然语言处理等新方法,利用真实世界数据开展生物制品安全监测。还设想建立一个分布式网络和一个创新方法交换平台。已有几份出版物获得批准。请参阅 BEST 以获取列表。BEST 最近发表的一份出版物使用大型商业保险数据库近乎实时地评估了 COVID-19 疫苗的安全性,证实了 mRNA 疫苗接种后心肌炎/心包炎和过敏反应的先前已知的安全信号。BEST 监测将继续识别可以进一步探索的感兴趣的安全信号。查看 BEST 研讨会系列,了解有关监测和真实世界数据方法的每月更新。
治疗方案 - 白血病和淋巴瘤协会
生物仿制药的制造方法。许多开发的药物被称为生物制品(称为“生物制剂”,也称为“参考产品”),因为生物制品是通过生物技术生产的,并使用微生物或植物细胞等生命系统。单克隆抗体和疫苗就是一些生物制品的例子。由于生物制剂的组成非常复杂,因此很难制造出仿制药。仿制药的开发更简单,就像按照标准成分的配方一样。生物仿制药更具挑战性,因为它们是由活细胞组成的,而活细胞对环境非常敏感,无法通过化学配方重现。制造商必须创建自己独特的流程,才能产生与现有治疗相同的结果。
根据《联邦食品、药品和化妆品法案》第 510(j)(3) 条报告所列药品和生物制品的数量
1 本指南由食品药品管理局药品评价与研究中心监管政策办公室和药品质量办公室与生物制品评价与研究中心及兽药中心合作制定。 2 在本指南中,“机构”和“设施”这两个术语可互换使用。 3 在本指南中,“制造”是指药品的制造、制备、繁殖、配制和加工。“制造、制备、繁殖、配制或加工”还包括重新包装和重新贴标签。请参阅 FD&C 法案第 510(a) 节;§ 207.1(21 CFR 207.1)(制造和制造商的定义)。 4 根据《联邦食品、药品和化妆品法案》第 510(j)(3)(B) 节,如果 FDA 确定应用此类报告要求对于保护公众健康并非必要,FDA 可发布命令,豁免《公共卫生服务法》第 351 节所监管的某些生物制品或某些类别的生物制品遵守《联邦食品、药品和化妆品法案》第 510(j)(3)(A) 节规定的部分或全部报告要求。FDA 已发布命令,豁免以下类别的生物制品遵守第 510(j)(3)(A) 节的报告要求:(i) 输血用血液和血液成分;以及 (ii) 细胞和基因治疗产品,其中一批产品用于治疗一位患者。参见 88 FR 22454(2023 年 4 月 13 日)。另见问题与答案 IV.J。5 就本指南而言,“医用气体”和“指定医用气体”具有《联邦食品、药品和化妆品法案》第 575 节中规定的含义。
疫苗和相关生物制品咨询委员会 2021 年 9 月 17 日会议简报文件 - FDA
本 BLA 补充材料包含针对参考菌株(野生型)评估的安全性和免疫原性数据,这些数据来自正在进行的 2/3 期研究 (C4591001) 中招募的约 300 名 18 至 55 岁免疫功能正常的成年人,这些成年人完成了由两剂肌肉注射 (IM) 的 BNT162b2 组成的初级疫苗接种系列,并在完成 2 剂初级系列后约 6 个月接受了 BNT162b2 加强剂量。未评估第 3 期 BNT162b2 加强组参与者的疗效。该研究第 1 阶段部分的支持数据还包括了在接种第二剂后约 7 至 9 个月接种了 30 µg BNT162b2 原型疫苗的 18 至 55 岁(N=11)和 65 至 85 岁(N=12)参与者中的支持数据,这些数据包括安全性数据和免疫原性数据,用于评估加强剂量针对参考毒株(野生型)SARS-CoV-2 和关注变体(VOC)引起的中和抗体滴度。
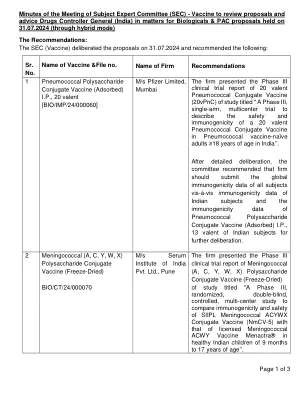
疫苗主题专家委员会 (SEC) 会议纪要,审查印度药品管理局关于生物制品问题的提案和建议
该公司提交了麻疹和风疹疫苗(活)IP(冻干)的 IV 期临床试验方案,题为“一项前瞻性、随机、平行、单盲、四组、活性对照、多中心的 IV 期临床试验,旨在评估印度血清研究所有限公司的麻疹和风疹疫苗(活)IP 与麻疹和风疹疫苗(活)IP(冻干)相比的免疫原性和安全性,并评估 Zydus Life sciences Ltd. 的麻疹和风疹疫苗(活)IP(冻干)在 9-12 个月健康婴儿中的批次间一致性。经过详细审议,委员会建议批准按照提交的方案进行 IV 期临床试验。