XiaoMi-AI文件搜索系统
World File Search System医疗政策和临床指南更新 2024 年 10 月 1 日
医疗政策和技术评估委员会 (MPTAC) 采用了以下新的和/或修订的医疗政策和临床指南。有些可能扩大了基本原理、医疗必要性指征或标准,有些可能涉及政策立场声明的变更,这可能导致之前涵盖的服务被发现不是医疗必需的或研究性的/不是医疗必需的。Anthem 采用的临床指南和所有医疗政策均可在 https://anthem.com/provider(选择提供商 > 医疗政策)上找到。请注意,我们的医疗政策现在包括未分类 (NOC) 代码,以加快确定可能需要医疗审查的服务的过程。您可以通过周一至周五上午 8 点至下午 7 点致电提供商服务部 800-241-7475 索取特定医疗或行为健康政策或临床利用管理 (UM) 指南的纸质副本,或发送书面请求(指定感兴趣的医疗政策或指南、您的姓名和应发送信息的地址)至:
脑电刺激和持续行为状态跟踪在行走人类中的应用
我们收集了 4 名患有药物抵抗性癫痫且植入了研究性 Medtronic Summit RC+S™ 的患者的动态 iEEG 记录,以研究新型刺激模式并追踪长期行为状态动态。患者在同时进行双侧海马 (HPC) iEEG 记录时接受了治疗性 ANT DBS。我们评估了在三天同时进行的 iEEG 和多导睡眠图 (PSG) 期间,使用专家睡眠注释,在不同 ANT 刺激频率 (2 Hz、7 Hz、高频 >100 Hz) [2,30–34] 下自动行为状态分类的可行性和准确性。使用朴素贝叶斯分类器 [35,36] 将 iEEG 信号分类为清醒、快速眼动 (REM) 和非 REM(非 REM:N2 和 N3)。随后,我们在 6 个月内将训练好的分类器部署在 4 名门诊患者身上。
三阴性乳腺癌的异质性
摘要简介:三阴性乳腺癌 (TNBC) 被认为是最具侵袭性的乳腺癌亚型,且预后最差。然而,最近的研究工作增进了人们对该疾病生物学的了解,并对支撑 TNBC 的多方面生态系统提供了新的、更全面的理解。涵盖的领域:在这篇综述中,作者说明了 TNBC 的主要生物学特征、分子驱动改变、可靶向基因以及在 TNBC 亚组中已确定的免疫参与生物标志物。因此,作者总结了从该疾病独特的生物学基础中出现的创新和研究性生物标志物驱动的 TNBC 治疗方案的概况。专家意见:TNBC 的治疗环境正在迅速发展。深入了解这种复杂疾病的肿瘤空间和时间异质性及其周围微环境可以有效地支持开发新的和有针对性的治疗机会。
人类克隆的法律范围
摘要 “生殖性”克隆和“治疗性”或“研究性”克隆都是有意创造基因相同的人类的行为。人类生殖性克隆通常受到许多国际和地区协议的禁止,包括《福岛宪章》、《欧洲人权和生物医学公约附加议定书》、世界卫生组织关于克隆对人类健康影响的决议以及《世界人类基因组和人权宣言》。然而,有些国家希望探索治疗性克隆,因此不能支持全面禁止克隆。本文旨在回顾英国和法国对人类克隆的法律地位,并进一步比较两国之间的问题。从英国和法国对人类克隆的法律地位来看,很明显这两个国家最初都反对人类克隆的想法和概念。人类克隆是一项急需的技术,尤其是在现代。我们每天都会遇到新的疾病和病痛,因此人类克隆对于帮助我们更好地应对未来至关重要。关键词:人类克隆;比较分析;英国;法国。
Nippon Shinyaku 与 Atsena Therapeutics 达成独家战略合作
日本京都和美国北卡罗来纳州达勒姆,2024 年 11 月 13 日——日本新药株式会社(Nippon Shinyaku;总部:京都;总裁,Toru Nakai)和 Atsena Therapeutics, Inc.(Atsena;总部:美国北卡罗来纳州达勒姆,首席执行官 (CEO):Patrick Ritschel)已达成独家许可协议,在美国境内商业化 ATSN-101,并在日本境内开发和商业化 ATSN-101,以推进 Atsena 的同类首创、研究性基因疗法 ATSN-101,用于治疗由 GUCY2D(LCA1)双等位基因突变引起的莱伯先天性黑蒙。根据许可协议的条款,Nippon Shinyaku 将获得在美国和日本的独家商业权利,而 Atsena 将保留在世界其他地区的商业权利。 ATSN-101将由日本新药在美国的全资子公司NS Pharma, Inc.(美国新泽西州,总裁:Yukiteru Sugiyama)销售
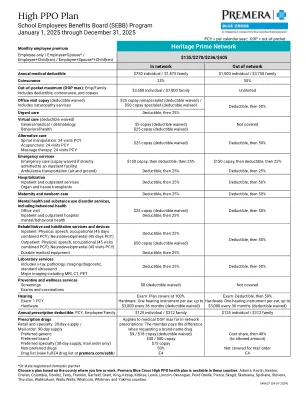
SEBB 计划强调高 PPO
一般排除和限制 以下是本健康计划不承保的一些服务和用品的列表。完整的排除列表可在 premera.com/sebb 上找到。 以下任何治疗、手术、服务、药物或用品均不提供福利: • 非医学必需的服务 • 整容手术或重建手术(特殊规定的除外) • 实验性或研究性服务 • 辅助生殖 • 减肥药物、食品和锻炼计划 • 超过特定福利最高限额的服务 • 由其他类型保险支付的服务,例如财产保险、责任保险或机动车保险 • 您未受本计划承保时获得的服务 • 提供者的执照或认证不允许其提供的服务。它也不承保没有国家要求的执照或认证的提供者。 • 性功能障碍 • 绝育逆转 某些服务、设备和药物需要事先获得 Premera 的授权才能获得承保。要了解在您接受保险之前需要获得您的计划预先批准的服务和程序的列表,请访问 premera.com/sebb 。
医疗政策 2.01.28 神经反馈...
• 生物反馈作为慢性疼痛的治疗方法 • 生物反馈作为大便失禁或便秘的治疗方法 • 生物反馈作为头痛的治疗方法 • 生物反馈作为成人尿失禁的治疗方法 • 生物反馈用于治疗其他适应症 • 定量脑电图作为注意力缺陷多动障碍的诊断辅助手段 福利申请 在所有情况下,福利确定都应基于适用的合同语言。如果这些指南与合同语言之间存在任何冲突,则以合同语言为准。请参阅会员接受服务时有效的合同福利,以确定这些服务是否适用于单个会员。一些州或联邦法令(例如联邦雇员计划 [FEP])禁止计划拒绝将食品和药物管理局 (FDA) 批准的技术作为研究性技术。在这些情况下,计划可能必须仅基于医疗必要性来考虑 FDA 批准技术的承保资格。监管状态 美国食品药品管理局 (FDA) 已通过 510(k) 流程批准多种脑电图反馈系统(脑电图硬件和计算机软件程序)上市销售。例如,BrainMaster ™ 2E(BrainMaster Technologies)“…适用于使用
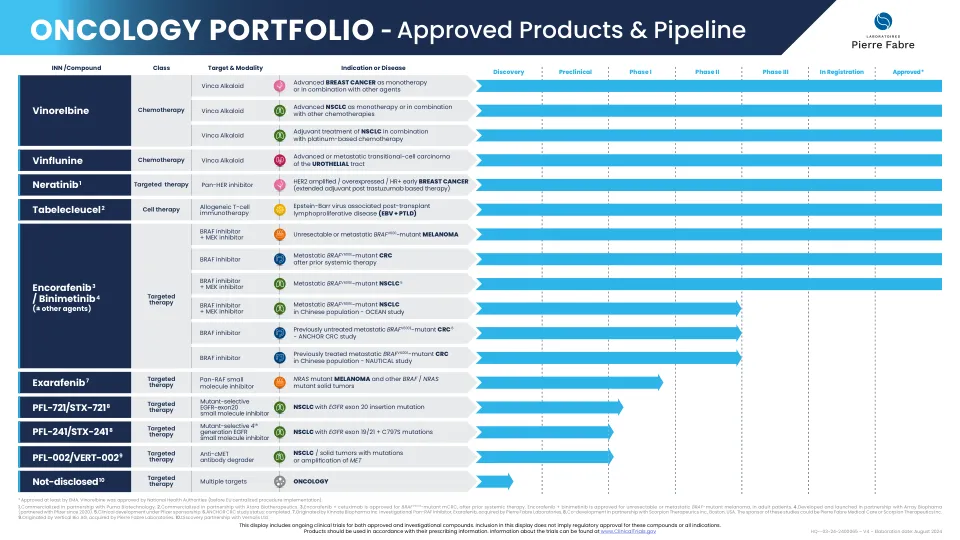
肿瘤学产品组合 - 已获批准的产品和研发管线
1. 与 Puma Biotechnology 合作进行商业化。2. 与 Atara Biotherapeutics 合作进行商业化。3. Encorafenib + 西妥昔单抗获批用于治疗 BRAF V600E 突变型 mCRC,此前已接受全身治疗。Encorafenib + binimetinib 获批用于治疗成人患者的不可切除或转移性 BRAF 突变型黑色素瘤。4. 与 Array Biophama(自 2020 年起与辉瑞合作)合作开发和推出。5. 在辉瑞的赞助下进行临床开发。6. ANCHOR CRC 研究状态:已完成。7. 由 Kinnate Biopharma Inc. 发起。研究性泛 RAF 抑制剂 Exarafenib 被 Pierre Fabre Laboratories 收购。8. 与美国波士顿的 Scorpion Therapeurics Inc. 合作共同开发。这些研究的资助方可能是 Pierre Fabre Medical Care 或 Scorpion Therapeutics Inc。9. 由 Vertical Bio AG 发起,后被 Pierre Fabre Laboratories 收购。10. 与 Vernalis Ltd. 建立发现伙伴关系。
数字脑电图 (DEEG) 分析
1. 安全有效; 2. 非实验性或研究性*; 3. 恰当,包括服务持续时间和频率是否恰当,取决于服务是否: • 是否按照公认的医疗实践标准提供,用于诊断或治疗患者的病情或改善畸形肢体的功能; • 是否在适合患者的医疗需要和病情的环境中提供; • 是否由合格人员安排和提供; • 是否满足患者的医疗需要,但不超过患者的医疗需要;以及 • 是否至少与现有的、医学上合适的替代方案一样有益。 * 符合临床试验 NCD 要求的合格临床试验服务的常规费用(服务日期为 2000 年 9 月 19 日或之后)被 Medicare 视为合理且必要。服务提供商应向原始医疗保险收取与符合医疗保险要求的临床试验相关的承保服务的费用(请参阅《医疗保险国家承保范围确定手册》第 1 章第 310 节和《医疗保险索赔处理手册》第 32 章第 69.0-69.11 节)。
ACDN-01是第一个进入临床开发的RNA外显子编辑器,也是唯一的
波士顿,2024年1月29日 - 一家渴望通过重写RNA治疗人类疾病的生物技术公司Ascidian Therapeutics今天宣布,美国食品和药物管理局(FDA)已清除了其研究性新药(IND)的应用,并批准了ACDN-01的快速轨道名称。ACDN-01是有史以来的第一个临床RNA外显子编辑器,也是针对Stargardt疾病遗传原因的唯一临床阶段治疗。Ascidian预计将在2024年上半年开始参加ACDN-01的1/2期ACDN-01恒星研究。“ FDA为ACDN-01开放的IND - 第一个清除ACDN-01进行临床开发的监管机构,代表了Ascidian的重要里程碑和更广泛的RNA编辑领域。”海外治疗学总裁兼临时首席执行官。“我们之所以选择首先去FDA,是因为我们对数据的严谨性有信念,并且通过编辑RNA而不是DNA,Aspidian方法带来了独特的优势,具有改变Stargardt病人的生活,并且更广泛地改变了遗传医学的范围。”