XiaoMi-AI文件搜索系统
World File Search SystemFDSS/μCELL 动态平板成像仪 C13299
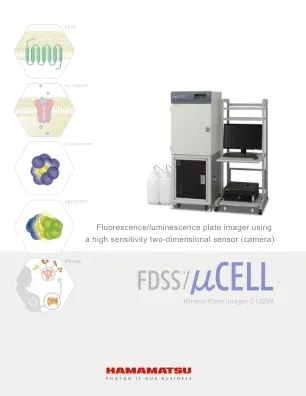
具有从荧光到发光的宽灵敏度范围的高灵敏度/高速相机。作为荧光/发光板成像仪,可高通量地执行各种测定。由于微孔板的所有孔都是同时读取的,因此在添加底物后,荧光指示剂或孔间测量没有时间滞后。要测量快速荧光动力学,可以使用高速数据捕获功能(可选)以最多 5 毫秒的间隔捕获数据。当需要在短时间内采样时,例如使用高速电压敏感荧光染料和评估 iPS 细胞衍生的心肌细胞时,它是有效的。对于荧光和发光的测量,通过 FRET 和 BRET 等能量转移进行双波长测量是离子通道和蛋白质动力学分析的有效方法。通过安装在传感器前面的荧光滤光片转换器,可以高通量地进行双波长测量。
大脑神经元网络的仿真可伸缩性得益于时间异步
处理。t这里有越来越庞大的研究项目,其1个目标是模拟大脑区域甚至完整的大脑2,以更好地了解其工作方式。让我们引用3个立场:欧洲的人脑项目(1),大脑4通过疾病研究的综合神经技术映射5(大脑/思想)在日本或大脑倡议(3)中,在6个联合国家中。几种方法是可行的。有7种生化方法(4),它注定了与大脑一样复杂的系统8。已经研究了一种更具生物物理的方法,例如,请参见(5),其中已成功模拟了皮质桶10,但仅限于10 5 11个神经元。然而,人脑含有约10 11个neu-12 rons,而像marmosets(2)这样的小猴子已经具有13 6×10 8神经元(6),而更大的猴子(如猕猴)具有14 6×10 9神经元(6)。15为了模拟如此庞大的网络,减少模型可以制作16个。特别是,神经元没有更多的物理形状,并且仅由具有18个特定电压的网络中的一个点表示。Hodgkin-Huxley方程(7),可以重现物理形状,代表了离子通道的动态,21,但这些耦合方程的复杂性形成了22个混乱的系统(8),使系统非常前端,使该系统非常前端,以模拟23个巨大的网络23。如果忽略了离子通道动态,则24个最简单的电压模型是集成与火的模型(9)。25使用此类模型,超级计算机26可以模拟人尺度的小脑网络,该网络达到约27 68×10 9神经元(10)。28然而,还有另一种观点,这可能使29我们可以使用简化的模型模拟此类大型网络。30的确,人们可以使用更多随机模型来重现31神经元的基本动力学:它们的插图模式。32不仅连接图的随机化,而且33图表上的动力学使模型更接近手头的34个数据,并在一定程度上解释其可变性。35随机的引入不是新的,并且在包括Hodgkin-Huxley(11)和泄漏37
第28届年度癌症研究研讨会
神经元和心肌细胞在其发展为成熟细胞类型的过程中都经历了结构和功能转化的复杂过程。在我们的实验室中,我们专注于渠道形成蛋白及其相互作用蛋白在这些过程中的作用。特别是,我们研究了通道蛋白及其与细胞骨架的串扰在调节与细胞分化和成熟相关的形态变化中的“无关”的作用。在本次演讲中,我将主要关注与神经元发育中的Pannexin 1通道蛋白和信号支架有关的发现,还将简要概述我们在心肌细胞发育中使用Ankyrin-b支架的离子通道和转运蛋白的ankyrin-b支架的工作。除了这些故事的发展方面外,我还将讨论我们的工作与特定的大脑和心脏状况的关系,这对治疗干预措施的诊断和发展产生了影响。
杂交微流体离子探针的设计和操作调节药物
承担这些分歧的全球负担。[1,2]新的且高度特定的药物输送工具将有助于更好地理解复杂的神经生物学环境,并为高度局部和精确的药物输送技术铺平道路。为了最佳工作,此类设备需要达到良好的化学和生物靶特异性,同时限制了生物相容性问题或相当的副作用。如果将这些设备作为最小化的独立探针实施,则可以轻松地操纵它们以靶向特定细胞,或与不同的实验设置和感应技术结合使用,以促进广泛的诊断和治疗能力,尤其是在深层组织/有机位置。[3]在这里,我们比较了两种高精度药物输送技术,基于压力的微流体和电离基质的能力和局限性。在微流体中,药物运输受到小型流体通道中的液压的高度控制。[4,5]通过连接几个流体源和微生物流体通道,可以轻松地进行混合,开关,筛查和递送各种药物。微流体的领域包括从实验室芯片设备到游离的微流体神经探针的多种实验设置。[4,6]其他感兴趣的技术是电离,其中应用电位的调节可以使精确的剂量控制和化学特异性,只要有效的药物或神经递质是积极或负电荷的。[7]最基本的离子基因组件是有机电子离子泵(OEIP)。[8]OEIP基于一个定义明确的和封装的离子交换膜(IEM),将源电解质储存液与目标电解质分开(通常称为“离子通道”)。从广义上讲,IEM的选择性取决于固定电荷的固有极性,其电荷程度以及其孔径和密度。通过IEM离子通道从源储存库中运输,并通过离子的迁移和被动扩散来积极实现目标电解质。通过改变IEM上的施加电位,可以通过电子控制迁移离子输送率,并且可以估算出施加的电子电流的直接对应关系,并且可以估算传递的药物数量。平面OEIP设备已成功地用于各种神经系统应用,例如,通过输送γ-氨基丁酸来抑制癫痫表现活性。
药物设计与发现评论文章 - ijrpr
药物发现可以描述为识别具有成为治疗剂潜力的化学实体的过程。药物发现活动的一个主要目标是识别可能对治疗未满足医疗需求的疾病有价值的新分子实体。这些疾病没有明确有效的治疗方法,并且实际上或可能危及生命。目前上市的药物代表了相对较少的药物靶标类型。针对 G 蛋白偶联受体、核(激素)受体和离子通道的药物占上市药物的 50% 以下。到目前为止,针对酶的药物占上市药物的最大份额。扩展到新类型的药物靶标可能是填补某些治疗空白的必要条件,但如何选择可能有价值的靶标是一个极具智力挑战的问题,尤其是在探索较少的药物靶标类型时[1]。
通过靶向药物再利用鉴定出 SARS-CoV-2 3a 通道阻断剂
摘要:COVID-19 大流行的病原体是 SARS-CoV-2。作为冠状病毒科的一员,这种包膜病原体有几种膜蛋白,其中两种,E 和 3a,被认为具有离子通道功能。为了增加我们的治疗选择,同时提供新的研究工具,我们试图通过靶向药物再利用来抑制 3a 通道。为此,我们使用三种基于细菌的检测方法,筛选了 2839 种获准供人类使用的药物库,并确定了以下潜在的通道阻滞剂:卷曲霉素、喷他脒、壮观霉素、春雷霉素、普乐沙福、氟马替尼、利特罗尼布、达拉帕地、氟尿苷和氟达拉滨。现在,我们已准备好在详细的电生理研究中检查这些化合物的活性及其在采取适当生物安全措施的情况下对整个病毒的影响。
crispr/cas9介导的鼠pa中的α-enac敲除...
许多离子通道参与控制胰岛β细胞的胰岛素合成和分泌。上皮钠通道(ENAC),但是ENAC在胰腺β细胞中的生物学作用尚不清楚。在这里,我们将CRISPR/ CAS9基因编辑技术应用于鼠胰腺β-细胞系(MIN6 Cell)中的敲除α -ENAC基因。为α -ENAC的外显子设计了四个单个指定RNA(SGRNA)位点。具有较高活性的SGRNA1和SGRNA3并共转染到MIN6细胞中。通过处理一系列实验流,包括药物筛选,克隆和测序,获得了MIN6细胞中的α -ENAC基因敲除(α -enac - / - )。与野生型MIN6细胞相比,细胞活力和胰岛素含量在α -ENAC - / - MIN6细胞中显着增加。因此,由CRISPR/CAS9技术产生的α-ENAC - / - MIN6细胞增加了研究胰腺β细胞中α -ENAC的生物学功能的有效工具。
在气孔门处争夺生存
气孔是植物与植物病原体之间的战场。植物可以感知病原体,从而诱导气孔关闭,而病原体则可以利用其植物毒素和诱导物克服这种免疫反应。在这篇综述中,我们总结了气孔-病原体相互作用的新发现。最近的研究表明,在细菌感染过程中,气孔运动继续以关闭-打开-关闭-打开的模式发生,这为气孔免疫带来了新的认识。此外,除了研究透彻的拟南芥-假单胞菌病原系统之外,典型的模式触发免疫途径和离子通道活动似乎在植物-病原体相互作用中很常见。这些发展有助于实现作物改良的目标。研究完整叶片的新技术和可用组学数据集的进展为理解气孔门的战斗提供了新方法。未来的研究应致力于进一步探讨与气孔免疫相关的防御与生长之间的权衡,因为目前我们对它知之甚少。
BTS 关于成人慢性咳嗽的临床声明
咳嗽是一种保护性反射,可防止吸入异物和咳出分泌物。72 气道受感觉神经元支配,其激活通过迷走神经传递到 73 脑干和更高级的中枢(图 1)。气道神经通过神经末梢上的受体(例如 TRPV1 和 TRPA1)感知刺激性、有害性或机械刺激 74。在健康或疾病状态下,75 这些受体的刺激可能会导致“咳嗽冲动”,同时喉咙发痒,导致咳嗽(9)。ATP 门控 P2X3 离子通道等受体也可以激活 77 气道神经;ATP 可能因细胞损伤、炎症和感染而释放。咳嗽 78 外周神经末梢的激活最终会进入复杂的中枢神经系统 (CNS) 网络 79,调节咳嗽反应。中枢神经系统内有重要的抑制外周兴奋性输入的中心。迷走神经支配的其他解剖区域,如耳朵(阿诺德反射)和食道,也可能导致咳嗽敏感性。