XiaoMi-AI文件搜索系统
World File Search System细胞周期阶段和 DNA 修复途径影响猪胚胎中 CRISPR/Cas9 基因编辑效率
摘要:CRISPR/Cas9 技术是一种用于在不同细胞类型和物种中操作基因组的强大工具。然而,与所有新技术一样,它仍然需要改进。不同的因素会影响 CRISPR/Cas 在受精卵中的效率,从而影响创建大型动物研究模型的总成本和复杂性。本研究评估了 CRISPR/Cas9 成分注射时早期注射(激活/受精后 6 小时内)与晚期注射(激活/受精后 14-16 小时)受精卵细胞周期阶段的重要性,以及 DNA 修复的同源重组 (HR) 途径的抑制对受精、精子注射、体细胞核移植和孤雌激活技术产生的胚胎的基因编辑、胚胎存活和发育的影响。与早期注射(86.3%;28.8%)相比,晚期细胞周期注射降低了胚胎存活率(以未裂解胚胎的比例衡量)和囊胚形成率(68.2%;19.3%)。然而,晚期注射(73.8%)的囊胚基因编辑率高于早期注射(63.8%)的囊胚。抑制 HR 修复通路可使早期注射的囊胚基因编辑效率提高 15.6%,而不会影响胚胎发育。我们的研究结果表明,在早期细胞周期注射以及 HR 抑制可提高猪囊胚的受精卵活力和基因编辑率。
阿那格雷对人类诱导性多能干细胞中细胞周期进程和巨核细胞祖细胞系成熟的抑制作用
巨核细胞系通常是未成熟细胞,不能转化为成熟的巨核细胞并产生血小板。正因为如此,使用细胞系或原代细胞对巨核细胞和血小板进行的一些常规研究被证明是有问题的。在本研究中,我们使用最近从人类诱导多能干 (iPS) 细胞建立的永生化巨核细胞祖细胞系 (imMKCL) 来阐明阿那格雷抑制血小板生成的分子机制。我们按如下方式制备 imMKCL。将含有 c-MYC、BMI1 和 BCL-XL 的强力霉素诱导慢病毒载体引入 imMKCL 以临床生产人工生成的血小板。6-8 去除强力霉素后,三种过表达的转基因被关闭;细胞开始分化,血小板在大约 5-7 天内生成(图 1A)。为了增强血小板的生成,在第 0 天添加了以下化合物:芳基烃受体拮抗剂 (SR1;美国马萨诸塞州默克密理博)、ROCK 抑制剂 (Y-27632;日本东京和光) 和 KP-457 (日本东京 Kaken Pharmaceutical Co. Ltd.)。KP-457 可有效保留糖蛋白 Ib (GPIb),也称为 CD42。如果没有它,GPIb 细胞外结构域的丢失会削弱血小板粘附细胞外基质并形成血栓的能力。9
CDK7 抑制剂作为抗癌药物
摘要 细胞周期依赖性激酶 7 (CDK7) 与细胞周期蛋白 H 和 MAT1 一起形成 CDK 活化复合物 (CAK),通过细胞周期 CDK 的 T 环磷酸化指导细胞周期进程。CAK 也是通用转录因子 TFIIH 的组成部分。CDK7 介导的 RNA 聚合酶 II (Pol II) 在活性基因启动子处的磷酸化允许转录。细胞周期失调是癌症的已知标志,通过多种机制对转录过程进行异常控制在许多癌症中也很常见。此外,CDK7 水平在许多癌症类型中升高并与临床结果相关,表明与正常组织相比,对 CDK7 活性的依赖性更大。这些发现将 CDK7 确定为癌症治疗靶点,最近的几篇出版物报道了选择性 CDK7 抑制剂 (CDK7i) 对多种癌症类型具有活性。临床前研究表明,CDK7i 可导致细胞周期停滞、凋亡和转录抑制,特别是癌症中超增强子相关基因的转录抑制,并已证明其具有克服癌症治疗耐药性的潜力。此外,CDK7i 与其他靶向癌症疗法(包括 BET 抑制剂、BCL2 抑制剂和激素疗法)的组合已在模型系统中显示出疗效。四种 CDK7i,ICEC0942 (CT7001)、SY-1365、SY-5609 和 LY3405105,现已进入 I/II 期临床试验。在这里,我们描述了导致选择性 CDK7i 开发的工作、最先进的临床候选药物的现状,并讨论了它们作为癌症治疗的潜在重要性,包括单一疗法和联合治疗。ClinicalTrials.gov 标识符:NCT03363893;NCT03134638;NCT04247126; NCT03770494。
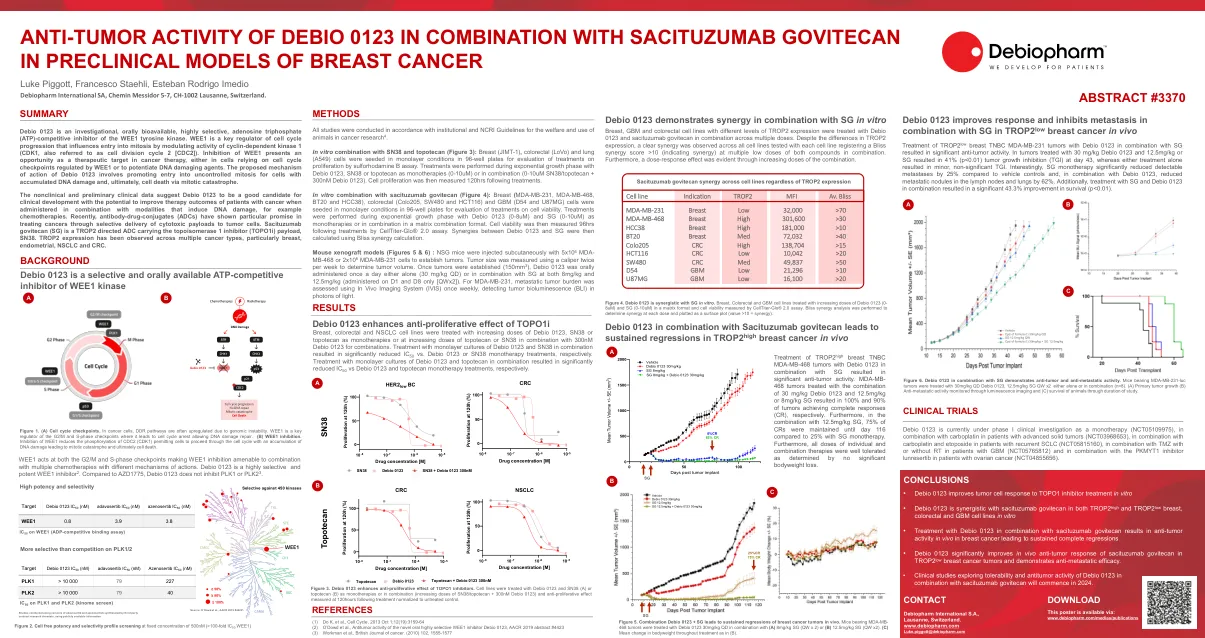
Debio 0123的抗肿瘤活性与...
debio 0123是一种研究性的,口服的,高度选择性的三磷酸腺苷(ATP) - WEE1酪氨酸激酶的竞争性抑制剂。wee1是细胞周期进程的关键调节剂,通过调节依赖细胞周期蛋白依赖性激酶1的活性(CDK1,也称为细胞分裂周期2 [CDC2])来影响有丝分裂的进入。抑制WEE1在依靠WEE1调节的细胞周期检查点或增强DNA损害剂的细胞中,在癌症治疗中提供了机会。提议的Debio 0123作用机理涉及促进具有累积DNA损伤细胞的不受控制有丝分裂,并最终通过有丝分裂灾难的细胞死亡。
DNA模拟的空间控制的蛋白水解靶向Cyclind1-CDK4/6复合蛋白降解的嵌合体
图2。距离和方向依赖性的选择性和Cyclin D1-CDK4/6复合物的降解。(a)DTAC距离库的示意图。(b)Western印迹(WB)分析显示,在用指定的DTAC变体以指定浓度处理的U-251细胞中细胞周期蛋白D1和CDK4/6降解14小时。结果代表了三个独立实验。(c)与距离依赖性DTAC治疗后对照组相比,相对细胞周期蛋白D1,CDK4和CDK6水平的定量。显示的数据是三个独立实验的平均值±SD。(d)DTAC方向库的示意图。(e)WB分析显示,在指定浓度的U-251细胞中,用指定的方向变体(DTAC-V5至DTAC-V9)处理的U-251细胞中的细胞周期蛋白D1和CDK4/6降解,持续14小时。结果代表了三个独立实验。(f)与对照组相比,用方向依赖性DTAC进行对照组进行了相对细胞周期蛋白D1,CDK4和CDK6水平的定量。显示的数据是三个独立实验的平均值±SD。
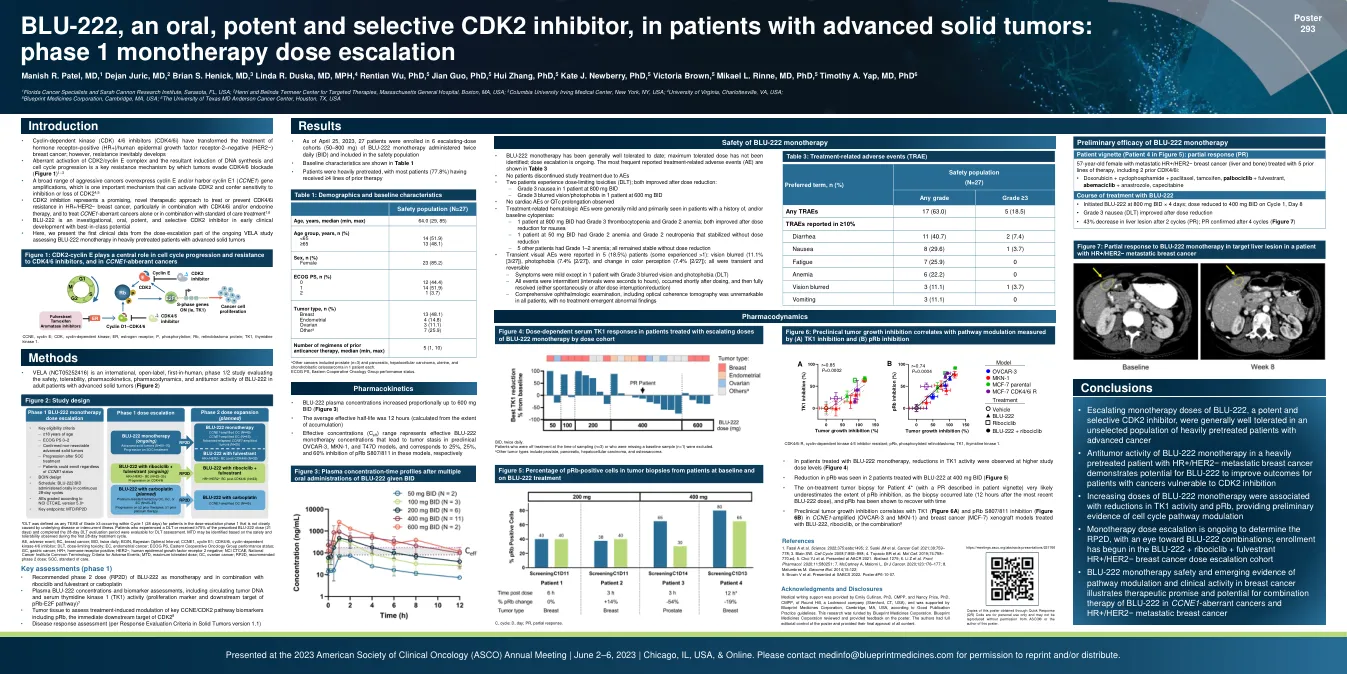
BLU-222 是一种口服、强效且选择性的 CDK2 抑制剂,...
• 细胞周期蛋白依赖性激酶 (CDK) 4/6 抑制剂 (CDK4/6i) 改变了激素受体阳性 (HR+)/人类表皮生长因子受体 2 阴性 (HER2-) 乳腺癌的治疗;然而,耐药性不可避免地会产生 • CDK2/细胞周期蛋白 E 复合物的异常激活以及由此导致的 DNA 合成和细胞周期进展的诱导是肿瘤逃避 CDK4/6 阻断的关键耐药机制(图 1)1-3 • 多种侵袭性癌症过度表达细胞周期蛋白 E 和/或携带细胞周期蛋白 E1(CCNE1)基因扩增,这是一种可激活 CDK2 并赋予对 CDK2 抑制或缺失的敏感性的重要机制 4,5 • CDK2 抑制代表了一种有前途的新型治疗方法,可用于治疗或预防 HR+/HER2-乳腺癌中的 CDK4/6i 耐药性,特别是与 CDK4/6i 和/或内分泌疗法相结合,以及单独或与标准治疗方法相结合治疗 CCNE1 异常癌症 1,6 • BLU-222 是一种在研的、口服的、强效的、选择性的 CDK2 抑制剂,处于早期临床开发阶段,具有同类最佳的潜力 • 在这里,我们介绍了第一个正在进行的 VELA 研究剂量递增部分的临床数据,该研究评估了 BLU-222 单药治疗接受过大量治疗的晚期实体瘤患者
口头和海报演示时间表
3 pp-3 PIH1D1的海报作用R2TP复合物在p53和细胞周期调节中的稳定中。 Dhiraj Kumar Singh博士18-Jan-25 1300-1400hrs(3分钟 + 1分钟)3 pp-3 PIH1D1的海报作用R2TP复合物在p53和细胞周期调节中的稳定中。Dhiraj Kumar Singh博士18-Jan-25 1300-1400hrs(3分钟 + 1分钟)
口服的小分子Bcl6抑制剂有效抑制弥散的大B细胞淋巴瘤细胞体外和体内生长
bcl6介导B细胞淋巴瘤细胞的存活率和细胞周期进程37。我们确定WK500B是否使用流式细胞术会影响DLBCL细胞周期的进程和细胞凋亡。结果(图3d,e)表明WK500B在S期诱导了明显的细胞周期停滞,并以2.5、5.0和10 µm的剂量引起剂量依赖性凋亡的诱导。阳性对照FX1不会在相同浓度下诱导细胞凋亡或细胞周期停滞(数据未显示)。总的来说,这些结果表明WK500B在体外诱导了DLBCL的死亡。3.4。WK500B表现出有利的药代动力学,并消除了体内生发中心的形成。
联合疗法中的 CDK4/6 抑制剂
细胞周期蛋白 D-CDK4/6 复合物在控制细胞周期中起着关键作用。许多类型的癌症都描述了细胞周期蛋白 D-CDK4/6 通路的失调,这必然会导致细胞增殖失控。人们已经付出了很多努力来开发能够抑制 CDK4/6 活性的靶向疗法。迄今为止,三种选择性 CDK4/6 小抑制剂已在临床上用于治疗激素阳性晚期乳腺癌患者,这得益于 III 期临床试验中取得的令人印象深刻的结果。然而,自这些抑制剂获批以来,临床证据表明,约 30% 的乳腺癌对 CDK4/6 抑制剂具有内在耐药性,长期治疗最终会导致许多患者产生获得性耐药性。因此,一方面,临床和临床前研究完全支持将 CDK4/6 抑制剂扩展到乳腺癌以外的领域,并扩大其在其他肿瘤类型的应用;另一方面,必须考虑原发性和继发性耐药性问题,因为现在非常清楚,肿瘤细胞在治疗下会迅速形成适应性策略,最终导致疾病进展。迄今为止发现的耐药机制涉及细胞周期和非细胞周期相关的逃逸策略。尚未完全理解,但已经阐明了许多不同的途径,如果靶向这些途径,可能会导致耐药表型的逆转。在这里,我们旨在总结该领域的知识,重点关注预测性生物标志物,以识别内在耐药性肿瘤和治疗策略,以克服获得性耐药性。