XiaoMi-AI文件搜索系统
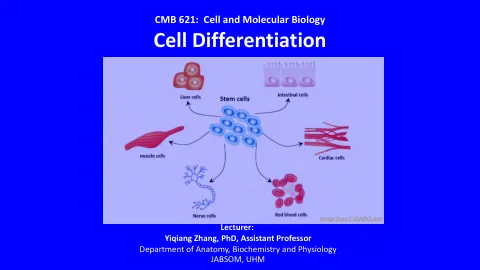
World File Search System细胞和分子生物学
并去除mRNA甲基化[9]。作者促进了M 6 A甲基化,并包括M 6 A甲基甲基甲基甲基化,Mettl3,Mettl5,Mettl14和其他亚基。橡皮擦是脱甲基酶,包括烷基化修复同源蛋白5(ALKBH5)和FTO。读者重新获得M 6 a-甲基化转录本,包括YTHDF1,YTHDF2和YTHDF3。这些调节蛋白通常在人类癌症中失调,并通过调节下游靶标和信号来促进或抑制癌症发展时发挥重要的功能[10]。Accu Multing研究工作已经证实,M 6修改可以通过CIRCRNA调节癌症的发展。例如,M 6 A介导的电路MDK的过表达促进了肝素癌癌的细胞增殖和侵袭[11]。ALKBH5介导的m 6循环CCDC134的修饰通过增强HIF1A转录加速了宫颈中的转移[12]。尽管如此,M 6的功能A的EC修饰及其对CIRCRNA的潜在调节机制尚不清楚。
小细胞肺癌
背景:同步的寡聚性非小细胞肺癌(NSCLC)通常以诊断时转移数量有限的特征。几项临床试验表明,该疾病所有部位的局部消融疗法(LAT)可能对寡聚NSCLC患者有益。近年来,程序性细胞死亡1(PD-1)抑制剂或程序性细胞死亡配体与细胞毒性化学疗法的结合已成为转移性NSCLC患者的新标准治疗方法。此外,多站点LAT可以固有地减轻整体肿瘤负担,这可能会促进T细胞重新燃烧以增强PD-1抑制剂的功效。很少有研究评估了PD-1抑制剂与LAT在所有疾病部位的疗效。本多中心单臂II期研究的目的是评估LAT在标准的铂双骨化疗与pembrolizumab在寡中NSCLC患者中的疾病所有部位的疗效。
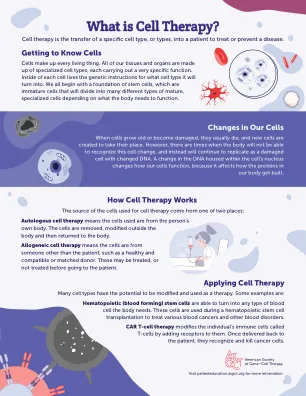
细胞疗法
1。基因和细胞疗法常见问题解答。美国基因和细胞疗法学会。2021年7月22日访问。https://asgct.org/education/more-resources/gene-and-cell-cell-therapy-faqs 2。NM Mount,Ward SJ,Kefalas P,HyllnerJ。基于细胞的治疗技术分类和转化挑战。哲学反应s s s b biol Sci。2015; 370(1680):20150017。 doi:10.1098/rstB.2015.0017 3。批准的细胞和基因治疗产物。美国食品和药物管理局(FDA)。出版于2021年6月15日。2021年7月23日访问。https://www.fda.gov/vaccines-blood-biologics/cellular-gene-gene-therapy-products/apprast-cellular--cellular-andular-and-gene-therapy-products 4。FDA专员Scott Gottlieb的声明,医学博士和Peter Marks,M.D.,Ph.D。,生物制度评估与研究中心主任,以推动开发安全和有效细胞和基因疗法的新政策。美国食品和药物管理局(FDA)。出版于2020年3月24日。2021年7月23日访问。https://www.fda.gov/news-events/press-announcements/statement-fda-commisserer-scott-gottlieb-md-md-md-md-md-md-mard-peter-marks-marks-marks-marks-marks-marks-mard-phd-director-center-center-center-center-center-center-center-center-center-center-biologics
先进细胞
新闻稿 AdvanCell 成功完成超额认购的 1.12 亿美元 C 轮融资 澳大利亚悉尼 – 2025 年 2 月 3 日 – AdvanCell 是一家开发创新癌症疗法的临床阶段放射性药物公司,今天宣布成功完成超额认购的 1.12 亿美元 C 轮融资。此轮里程碑式的融资由 SV Health Investors、Sanofi Ventures、Abingworth 和 SymBiosis 共同领投。现有投资者 Morningside 以及新投资者 Tenmile、Brandon Capital 等也提供了额外支持。自 2019 年 6 月成立以来,AdvanCell 从一个对靶向 Alpha 疗法潜力的信念成长为一个全球性组织,拥有 60 名热情的团队成员、40,000 平方英尺的制造工厂、世界一流的临床前基础设施、一种可能处于同类最佳的前列腺癌药物(正在试验中)和深厚且正在开发的资产管线。这项投资将推动 AdvanCell 持续努力扩大其生产能力,加速其放射性核素疗法产品线的临床开发,并推进其为全球癌症患者提供改变生活的治疗的使命。AdvanCell 目前正在招募患者参加其多中心 TheraPb Ph I/II 剂量递增临床试验 ADVC001 的最高剂量组,该试验针对转移性前列腺癌,是一种潜在的最佳靶向阿尔法疗法。该试验旨在证明基于 Pb-212 的放射性核素治疗的安全性和有效性。作为融资的一部分,SV Health Investors 的 Jamil M. Beg、Sanofi Ventures 的 Christopher Gagliardi 和 Abingworth 的 Bali Muralidhar 加入了 AdvanCell 董事会。他们带来了丰富的行业专业知识来支持公司的发展,并加入了现有董事 Bill Ferris AC、Anthony Aiudi、Kevin Cameron 和 Andrew Adamovich 的行列。 SV Health Investors 合伙人 Jamil M. Beg 表示:“我们很高兴能够支持 AdvanCell 的发展,并通过领投本次超额认购的 C 轮融资,在其非凡旅程中发挥作用。我们对放射性核素治疗领域进行了长期而深入的研究,并相信 AdvanCell 凭借一流的 Pb-212- PSMA 项目和一流的制造平台脱颖而出。公司拥有优秀的团队、技术、强大的基础设施、与一些全球最大制药公司的合作以及持续的执行能力,能够真正改变患者的治疗结果。我们很高兴能够帮助 AdvanCell 发挥其在全球癌症治疗变革中的潜力。” AdvanCell 成立的基础是这样的信念:靶向阿尔法疗法可以改变癌症治疗的进程,而可扩展的同位素供应将能够开发多种改变实践的药物。前列腺癌和胃肠胰神经内分泌肿瘤的放射性核素疗法已经改变了患者护理。Pb-212 靶向阿尔法疗法有可能进一步推动这一进展,利用 Pb-212 的放射生物学和物理特性为患者提供改变生活的治疗。AdvanCell 首席执行官 Andrew Adamovich 表示:“此次成功的 C 轮融资表明了我们对愿景和能力的强烈信心。”“我们感谢现有投资者的持续支持,尤其是 Morningside 的长期支持,并很高兴欢迎与我们一样致力于改变癌症治疗的新合作伙伴。”
细胞和基因治疗
治疗至少 4 岁的杜氏肌营养不良症患者 Elevidys 是一种腺相关病毒基因疗法,最初于 2023 年 6 月获批用于治疗 DMD 基因确诊突变的 4 至 5 岁门诊 DMD 儿科患者。该适应症获得加速批准,基于在接受 Elevidys 治疗的患者中观察到的 Elevidys 微肌营养不良蛋白的表达,继续批准取决于确认性试验。Elevidys 禁用于 DMD 基因外显子 8 和/或外显子 9 存在任何缺失的患者。2024 年 6 月,FDA 批准扩大 Elevidys 的标签适应症,将 DMD 基因确诊突变且年龄至少 4 岁的 DMD 患者纳入其中。为确认功能益处,FDA 批准了对门诊患者的传统批准。FDA 批准了对非门诊患者的加速批准。是否继续批准用于非卧床性 DMD 患者可能取决于在确认性试验中对临床益处的验证。Elevidys 仍禁用于 DMD 基因外显子 8 和/或外显子 9 存在缺失的患者。
无细胞DNABCT®
+首先和唯一的无细胞DNA稳定全血收集装置被美国FDA +清除的全血收集装置可减少与K 2 EDTA +相比,可用于释放细胞基因组DNA +用于批准的液体活检的批准的下一代测序分析*
细胞疗法
最受过临床试验的细胞,间充质基质细胞(MSC)现在已知主要通过包括外泌体的旁分泌分泌发挥其治疗活性。为了减轻对MSC外泌体制备的可伸缩性和可重复性的潜在调节问题,使用高度表征的MYC降低的单克隆细胞系产生MSC外泌体。这些细胞不会在无胸腺裸鼠或表现出与锚固无关的生长中形成肿瘤,并且它们的外泌体不携带MYC蛋白或促进肿瘤生长。与腹膜内注射不同,MSC在IMQ诱导的牛皮癣的小鼠模型中的局部应用减轻了白介素(IL)-17,IL-23和末端组合复合物,C5B9在牛皮乳肌皮中。应用于人类皮肤外植体时,从共价标记的荧光MSC外泌体的荧光渗透并持续在角质层中,大约24小时,而从角质层中忽略不计,将其从角膜层中忽略不计。作为牛皮癣的角膜层的特征在于活化的补充和Munro微鳞片,我们假设局部施用的外泌体渗透到牛皮癣的角膜层以抑制C5B9补体通过CD59抑制CD59,并且这种抑制作用抑制了中性粒细胞粒细胞的IL IL-17。与此相一致,我们证明了C5B9在纯化的人类嗜中性粒细胞诱导的IL-17分泌上的组装,MSC外泌体使这种诱导构成了这种诱导,这又被中和中和的抗CD 59抗体所消除。因此,我们确定了通过局部应用外泌体缓解银屑病IL-17的作用机理。由Elsevier Inc.出版©2023国际细胞和基因治疗学会。这是CC BY-NC-ND许可(http://creativecommons.org/licenses/by-nc-nd/4.0/)下的开放访问文章