XiaoMi-AI文件搜索系统
World File Search SystemOTS - 基因编辑专利.docx
Prime 编辑通过使用向导 RNA 将 Prime 编辑复合物引导至 DNA 内的特定位置来实现这一点。该复合物含有一种经过修饰的 Cas9 蛋白,称为“Prime 编辑器”,与逆转录酶融合 (2)。Prime 编辑器旨在识别特定的 DNA 序列并切割双螺旋的一条链,从而使逆转录酶能够使用未切割的链作为模板,在切割位点添加或删除特定核苷酸。
IBM WebSphere Business Modeler V7.0 中的新增功能
您可以直接在 WebSphere Business Modeler 中使用 WebSphere Business Compass 中提供的工具和编辑器来创建高级 BPMN 样式的流程模型。作为行业标准,BPMN 对于业务用户和不熟悉 Eclipse 环境的用户来说非常直观。Business Designer 透视图支持 BPMN 2.0 的描述子集,并提供基本流程编辑和其他功能视图,例如演练、历史记录和顾问。还有用于定义数据、角色、服务和协作的相关编辑器。
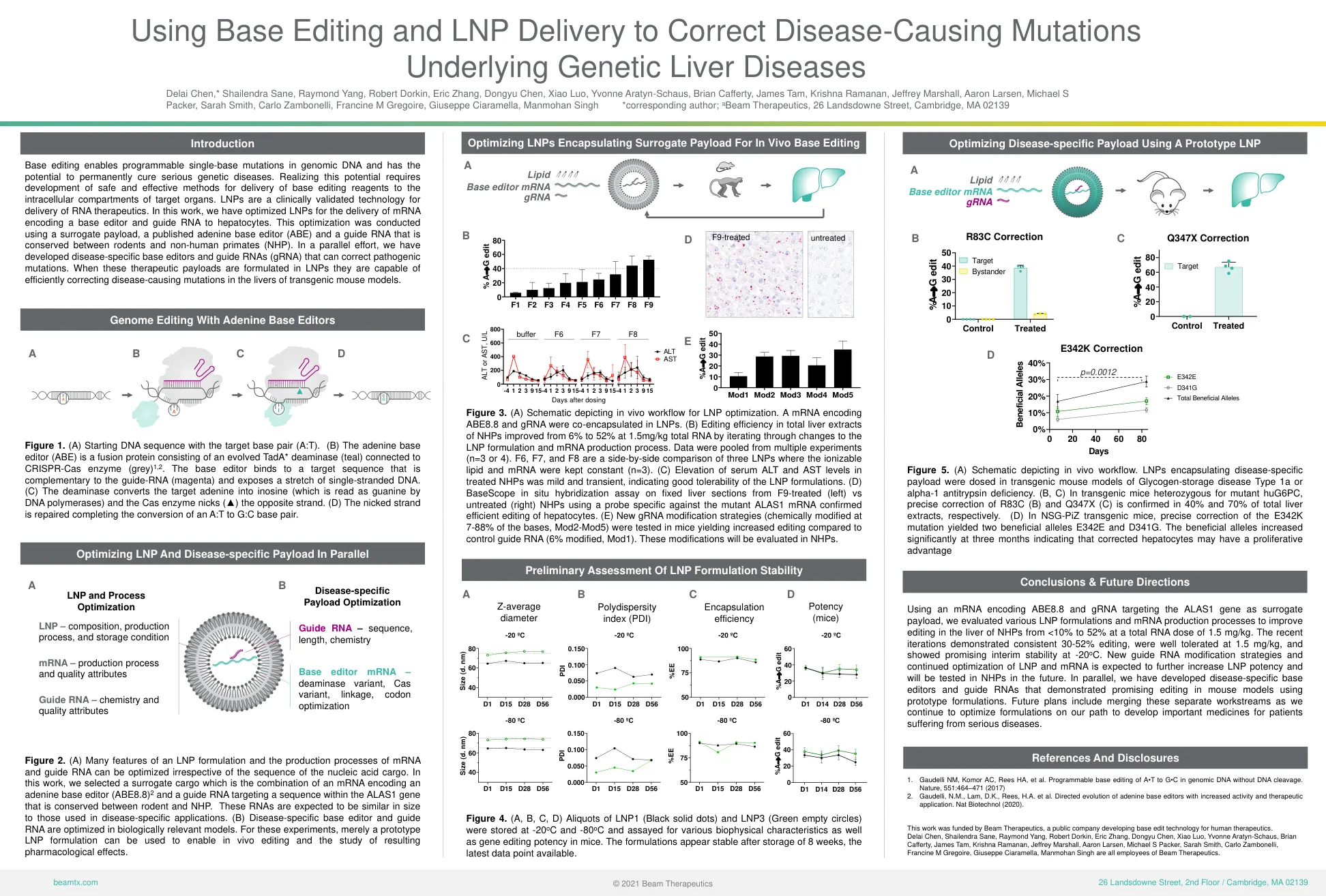
并行优化LNP和特定疾病的有效载荷...
基础编辑可以使基因组DNA中可编程的单基碱基突变,并有可能永久治愈严重的遗传疾病。意识到这一潜力需要开发安全有效的方法,以将基础编辑试剂传递到目标器官的细胞内隔室。LNP是一种经过临床验证的RNA疗法的技术。在这项工作中,我们优化了LNP,用于传递编码基本编辑器的mRNA,并将RNA引导至肝细胞。使用替代有效载荷,已发表的腺嘌呤基本编辑器(ABE)和在啮齿动物和非人类灵长类动物(NHP)之间保守的指导RNA进行了优化。在平行的努力中,我们开发了疾病特异性的基础编辑器和指导RNA(GRNA),可以纠正致病性突变。当这些治疗有效载荷是在LNP中提出的,它们能够在转基因小鼠模型的肝脏中有效纠正引起疾病的突变。
碱基编辑格局扩展以执行颠换突变
为什么我们需要颠换碱基编辑器? CRISPR-Cas9 系统彻底改变了基因组工程领域。该系统通过在基因组中生成小的插入/缺失,可高效地引起靶向敲除。从一个核苷酸到另一个核苷酸的精确修改需要充足的供体模板供应和同源定向修复 (HDR) 途径的诱导 [1]。胞嘧啶碱基编辑器 (CBE) 和腺嘌呤碱基编辑器 (ABE) 的发明使我们能够在没有供体模板的情况下在 DNA 或 RNA 中进行靶向 C 到 T 和 A 到 G 的转换 [2-5]。CBE 和 ABE 都已广泛应用于各种生物体,以创建或纠正点突变,用于不同的应用 [5、6]。然而,CBE 和 ABE 仅催化碱基转换(嘌呤到嘌呤或嘧啶到嘧啶),并且只能用于实现 12 种可能的碱基替换中的 4 种。尽管如此,许多生物、治疗和作物改良应用都需要
将受精卵注射到牛胚胎中,对自然发生的序列变异进行基因组编辑
基因组编辑通过有针对性地引入天然序列变体,加速遗传增益,为改进当前的牛育种策略提供了机会。这可以通过在修复模板存在的情况下利用编辑器诱导的基因组切割后的同源性定向修复机制来实现。将基因组编辑器引入受精卵并在胚胎中进行编辑的优势在于,活体动物的发育不会受到影响,并且与当代基于胚胎的改良实践保持一致。在我们的研究中,我们调查了引入已知的前黑素体蛋白 17 ( PMEL ) 和催乳素受体 ( PRLR ) 基因的序列变体,并产生完全转化为精确基因型的非嵌合体编辑胚胎的潜力。将 gRNA/Cas9 编辑器注射到牛受精卵中以将 3 bp 缺失变体引入 PMEL 基因,可产生高达 11% 的完全转化胚胎。使用 TALEN 后,转化率提高到 48%,但前提是通过质粒递送。在几种已知 PRLR 序列变体、不同修复模板设计和 DNA、RNA 或核糖核蛋白传递的背景下测试三种 gRNA/Cas9 编辑器,实现了高达 8% 的完全转化率。此外,我们还开发了一种基于活检的非嵌合体胚胎筛选策略,该策略有可能专门生产具有预期精确编辑的非嵌合体动物。