XiaoMi-AI文件搜索系统
World File Search System肠道菌群与失眠之间的因果关系
失眠是指经常和持续的困难入睡或保持睡眠的特征,尽管睡眠机会和睡眠环境适当(Sutton,2021; Cunnington等,2013)。该疾病的特征主要是在入睡,梦幻,易于觉醒和早期觉醒方面很难,并且经常伴有身体症状(疼痛,神经和麻木)和精神障碍(抑郁,焦虑,焦虑和烦躁)。根据统计数据,超过30%的全球人口经历了一种或多种失眠症状(Madari等,2021),严重影响了患者的生活和工作。失眠的发病机理非常复杂。失眠的发生和发展与个体因素和各种环境因素密切相关。易感因素,诱导因素和维持因素起着非常重要的作用(Proserpio等,2020)。最近,越来越多的证据表明,肠道菌群的变化与宿主健康密切相关(Agus等,2018; Morrison和Preston,2016)。微生物群 - 肠道 - 脑轴已得到确定,与多系统疾病(如神经系统)有关,并参与许多精神疾病的发病机理(Forslund等,2017; Cox and Weiner,2018; Looo等,2020)。肠道菌群称为人体的“第二基因组”(Preethy等,2022)。现在认为细菌与人类细胞的比率接近1:1,其中所含的基因是人类编码基因的100倍。Thaiss等。肠道微生物群已被证明可以通过参与食物消化和分解来调节身体健康和大脑的功能(Burokas等,2017),调节胆汁酸代谢(Burokas等,2017),抵抗病原体,抵抗病原体的入侵(Cheng等,2019),并参与免疫反应,并参与免疫反应(Yang and Cong,Yang,20211)。目前,已经有关于失眠和肠道菌群的报道。(2016)发现,一方面,改变小鼠的睡眠模式可以改变其肠道微生物群的结构和多样性,另一方面,改变了
引用了原始发表的论文(记录的版本):Jernfors,T.,Lavrinienko,A.,Vareniuk等(2024)。肠道治疗之间的关联
动物在其胃肠道中拥有复杂的细菌群落,它们与之共享相互作用。这些对宿主的相互作用赠款的众多影响包括对免疫系统的调节,防御病原体入侵的防御,原本无法消化的食物的消化以及对宿主行为IOR的影响。暴露于压力源,例如环境污染,寄生虫和/或捕食者,可以改变肠道微生物组的组成部分,可能影响宿主 - 微生物组相互作用,这些相互作用可以在宿主中表现出来,例如代谢功能障碍或炎症。然而,很少检查野生动物伴侣中肠道微生物群的变化。因此,我们量化了野生银行是否居住在污染环境中,存在环境放射性核素的区域是否表现出肠道微生物群的变化(使用16S扩增子测序)以及使用转录组学的组合方法在宿主健康中发生变化,并使用转录组学的组合方法,组织学构成组织的组织学分析,对短篇小说和较短的细胞酸性酸性酸性酸性酸性酸性酸性酸性酸性。与居住在受污染区域的动物中肠道微生物群发生变化的同时,我们发现宿主中肠道健康不良的证据,例如杯状细胞降低,可能会削弱
引用Zhang Q,Wang H,Tian Y,Li J,Xin Y和Jiang X(2024)Mendelian随机分析,以研究口服和Oropha中的肠道微生物组
头颈癌是全球第六个最常见的癌症(Warnakulasuriya,2009年),口服和口咽癌是最常见的亚型。烟草和酒精消耗(Hashibe等,2009),人乳头瘤病毒(HPV)感染(Ang等,2010)和特定的性行为(Heck等,2010)已被认为是口腔和口腔和口腔咽部癌症癌症危险因素。最近,人们对癌症与微生物组之间的联系越来越多。特别是,在肠道微生物组中已经观察到癌症相关的生物标志物(Cullin等,2021)。肠道菌群是肠道中存在的细菌种类的集合。肠道微生物在肿瘤中的作用可以分为局部和远端角色(Matson等,2021)。除了特异性肠道微生物在局部致癌作用中具有的重要作用外,肠道微生物还可以改变宿主的整体免疫系统,从而导致癌症(Castellarin等,2012; Amieva and Peek,2016)。肠道微生物与肠上皮之间存在天然的解剖屏障,主要由分泌肠道粘液的杯状细胞组成(Kim和Ho,2010)和产生抗菌肽的细胞(Salzman等人(Salzman et al。,2007))。因此,肠道微生物与免疫系统之间的接触受到限制。但是,特定的微生物会影响肠道屏障的完整性。益生菌调节免疫系统是一种潜在的抗肿瘤策略(Vétizou等,2015)。当这种完整性被破坏时,癌的数量越来越多,通过受损的肠道障碍循环(Rajagopala等,2017);此外,诱导了炎症或免疫抑制,在促进癌症中起间接作用(Yu and Schwabe,2017)。An example illustrating this distal role is that the gut microbiota can promote hepatocellular carcinoma and pancreatic cancer growth/progression/invasion and metastasis, which contain no known microbiome, by elevating cancer- promoting in fl ammatory microbial-associated molecular patterns such as lipopolysaccharides ( Dapito et al., 2012 ; Ochi et al., 2012 ).肠道微生物可以通过调节肠上皮屏障的原发性和继发性淋巴机构来调节免疫力,从而影响肿瘤微环境(Gopalakrishnan等,2018)。先前已经报道了肠道微生物与肠肿瘤敏感性之间的关联(Yachida等,2019)。肠道微生物群已被证明通过调节免疫细胞功能,影响炎症反应,调节免疫耐受性(Zhou等,2021)和产生代谢物(Zhang等,2019)。然而,肠道菌群与肠胃外肿瘤(尤其是口咽和口服癌症)之间的因果关系尚不清楚。Mendelian随机化(MR)是一种统计方法,用于根据工具变量(遗传变异)评估暴露与结果之间的因果关系,可以看作是随机对照试验(RCT)的自然类似物。因此,我们旨在研究肠道菌群是否与口服和与传统的黄金标准RCT相反,参与者根据其基因型分配,从而减少了反向因果关系和混杂因素(例如道德和社会经济因素)的影响。
2025; 16(7):2087-2102。 doi:10.7150/jca.104389研究论文胆固醇代谢相关的基因预测胃肠道的免疫浸润和预后
背景:胃癌(GC)是全球最普遍的恶性疾病之一。异常的代谢重编程,尤其是胆固醇代谢,会影响肿瘤的发展和治疗结果。这项研究研究了胆固醇代谢相关基因在胃癌患者中的预测和功能意义。方法:使用来自基因表达综合基因综合(GEO)和癌症基因组图表(TCGA)的数据集分析了胃癌中与胆固醇代谢相关的临床和基因表达数据。使用Lasso,Cox回归和GSE26889队列开发并验证了预测签名,然后使用Kaplan-Meier分析进行评估。通过将签名与临床因素和SSGSEA整合进行免疫分析来构建一个nom图。使用Western印迹,QPCR和细胞测定法研究了NPC2的作用。结果:我们对胃癌中胆固醇代谢相关的50个基因进行了生物信息学分析。使用GEO和TCGA数据集,我们确定了28个基因在胃癌患者中表达差异。随后的Cox Univariate和Lasso回归分析分析了这28摄氏度,将五个基因(APOA1,APOC3,NPC2,CD36和ABCA1)确定为独立的预后风险因素。然后,我们为胆固醇代谢基因构建了一个风险模型,表明与低风险组相比,高危组的生存率较差,并具有更严重的病例分期结果。然后,我们使用相关列图开发了一个模型来说明这些结论。我们对高危和低风险组之间的免疫细胞进行了比较分析,揭示了免疫细胞类型表达的不同变化。我们进一步研究了NPC2的生物学特征。免疫组织化学和QPCR结果表明,NPC2在胃癌组织中表现出明显的蛋白质和mRNA表达。我们使用siRNA技术来抑制NPC2,从而降低了胃癌细胞的生存力,增殖和侵袭能力,这是由CCK-8,菌落形成,伤口愈合和Transwell分析确定的。结论:使用生物信息学构建了一个包括五个胆固醇代谢相关的基因的风险签名,以估计胃癌患者的结局和治疗反应。结果表明NPC2可以作为胃癌患者的新生物标志物。
肠道微生物代谢和人类视觉神经回路的共同开发
。cc-by 4.0国际许可证是根据作者/资助者提供的,他已授予MedRxiv的许可证,以永久显示预印本。(未通过同行评审认证)
描述促进皮肤,口服和肠道
在生理出生期间,早期微生物群播种对于内分泌,代谢和免疫系统中新生儿皮肤,口服和肠道微生物组的发育至关重要。微生物组定义了体内存在的真菌,病毒和细菌等微生物,尤其是皮肤,肺,肠,阴道和口腔,并且对于保护短期和长期健康至关重要。1有一些证据表明羊水中也存在微生物群,并且妊娠10至13周,胎儿吞咽反射显而易见,这意味着在出生前的胎儿胃肠道肠道疾病中已经存在保护性肠道肠道微生物。2胎儿还涂在vernix caseosa中,该caseosa保护子宫中的皮肤并含有抗菌酶。新生儿皮肤微生物组最初反映了它主要暴露于出生时的微生物群,无论是来自阴道还是孕妇皮肤。
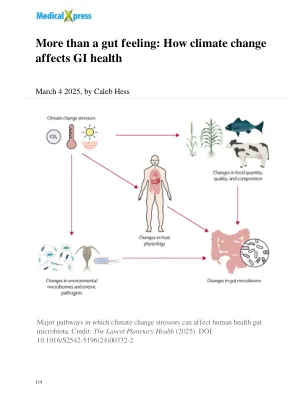
不仅仅是一种直觉:气候变化如何影响胃肠道健康
在中低收入国家,尤其是在热带地区的国家中,胃肠道疾病的激增带来了多方面的威胁。环境变化促进了病原体的生长和扩散,而热应激和食物不安全性降低了人类自然免疫功能的疗效。这些国家的适应粮食短缺的能力也不是高收入国家,导致对已经受热压力,疾病和粮食不安全感影响的国家产生不成比例的影响。
较长的母乳喂养与某些婴儿肠道细菌的血压降低作用有关
研究人员认为,这些关联可能有几个原因。某些肠道细菌已经进化出了专门的生物学机制,使他们可以将母乳中的原样不可消化的碳水化合物转化为人体可以使用的卡路里和物质。在分解这些碳水化合物并将它们变成可能影响血压和支持心血管健康的短链脂肪酸并将其变成短链脂肪酸方面,包括B. iftantis在内的特定双歧杆菌是超级巨星。