XiaoMi-AI文件搜索系统
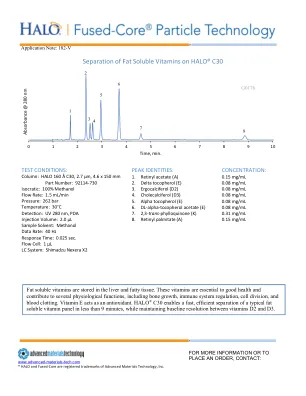
World File Search System在 HALO® C30 上分离脂溶性维生素
脂溶性维生素储存在肝脏和脂肪组织中。这些维生素对健康至关重要,有助于多种生理功能,包括骨骼生长、免疫系统调节、细胞分裂和血液凝固。维生素 E 可作为抗氧化剂。HALO ® C30 可在不到 9 分钟的时间内快速、高效地分离典型的脂溶性维生素组,同时保持维生素 D2 和 D3 之间的基线分辨率。
108年度科学论文发表统计(生命科学类)共16篇
慢性过氧化物组增殖物激活的受体α/γ和大麻素受体2激动剂治疗减弱了内脏脂肪组织(VAT)衍生的细胞外囊泡相关的增值税和非酒精性steatoholic steatoholic steatoholic steatoholic steatohololic sterepatial steathepation Pio hepatial poceathepation pipation steatohocial pipation steatohocial pipation。AM J Pathol。2024年10月26日:S0002-9440(24)00398-5。
新颖性陈述这是预先发布的版本。
以下出版物Yuan,B.,Zhao,D.,Lyu,W.,Yin,Z.,Kshatriya,D.,Simon,J。E.(2021)。具有高通量增强的矩阵去除的微级方法的开发和验证,然后用UHPLC-QQQ-MS/MS进行了用于分析脂肪组织中与覆盆子酮相关的酚类化合物的分析。talanta,235,122716可在https://doi.org/10.1016/j.talanta.2021.122716获得。
肥胖的遗传学 - living.hhu.de
Mikael Rydén 是临床和实验脂肪组织研究教授,并担任卡罗琳斯卡医学院糖尿病临床代谢研究中心和内分泌科主任。他还是瑞典斯德哥尔摩卡罗琳斯卡大学医院内分泌学/糖尿病学高级顾问。他的研究重点是人类脂肪组织在几种不同情况下的作用,涵盖从不同细胞培养模型中的先进细胞和分子生物学技术到人体临床研究。他曾担任 2018 年至 2022 年欧洲糖尿病协会名誉秘书,也是卡罗琳斯卡医学院诺贝尔大会当选成员。近期出版物选 Maqdasy S、Lecoutre S、Renzi G、Frendo-Cumbo S、Rizo-Roca D、Moritz T、Juvany M、Hodek O、Gao H、Couchet M、Witting M、Kerr A、Bergo MO、Choudhury RP、Aouadi M、Zierath JR、Krook A、Mejhert N、Rydén M。磷酸肌酸代谢受损白色脂肪细胞会促进炎症。纳特·梅塔布。 2022 年 2 月;4(2):190-202。 DOI:10.1038/s42255-022-00525-9。 Epub 2022 年 2 月 14 日。PMID:35165448; PMCID:PMC8885409。
运动作为减轻代谢疾病的工具
代谢性疾病的越来越多,包括肥胖,2型糖尿病(T2D)和高血压等等,在近几十年来,已经达到了令人震惊的比例,成为全球负担(1)。特别是关于肥胖症和2型糖尿病的,据估计,全世界有650万人的成年人具有肥胖症(体重指数30 kg/m 2),超过5.37亿成年人患有2型疾病(2,3)。大量证据表明,久坐的行为或不足水平的体育活动是代谢性疾病的发展涉及的关键方面,并有助于缩短预期寿命(4-6)。运动训练在包括肥胖症和T2D在内的慢性疾病的预防和治疗中具有核心作用。对代谢健康的运动有许多好处和适应性,包括但不限于葡萄糖耐受性,胰岛素敏感性,氧化还原健康,对肠道微生物群的适应和减少infl肿瘤的改善(7-10)。此外,在几个代谢组织中观察到阳性运动的阳性适应性,尤其是在骨骼肌,脂肪组织和肝脏中(11)。在这篇综述中,我们将讨论肥胖与2型糖尿病之间的关系,这些疾病如何影响代谢组织,以及运动诱导的脂肪组织,肌肉肌肉和肝脏的适应如何改善代谢健康。
内脏肥胖发病机制中可能的关键因素
背景和目的:心血管、肾脏和脂肪组织中血管紧张素 II 型受体相关蛋白 (ATRAP) 表达失调与高血压、心脏肥大、动脉粥样硬化、肾脏损伤和代谢紊乱的病理有关。此外,ATRAP 在骨髓来源的免疫细胞中高度表达;然而,免疫细胞 ATRAP 在肥胖相关病理中的功能作用仍不清楚。因此,我们试图使用饮食诱导的肥胖小鼠模型来确定免疫细胞 ATRAP 在内脏肥胖和肥胖相关代谢紊乱发展中的病理生理意义。方法:首先,我们检查了高脂饮食 (HFD) 诱导的肥胖对野生型小鼠免疫细胞 ATRAP 表达的影响。随后,我们进行了骨髓移植以产生两种类型的嵌合小鼠:骨髓野生型嵌合 (BM-WT) 和骨髓 ATRAP 敲除嵌合 (BM-KO) 小鼠。这些嵌合小鼠被提供 HFD 来诱导内脏肥胖,然后研究免疫细胞 ATRAP 缺乏对嵌合小鼠生理参数和脂肪组织的影响。结果:在野生型小鼠中,HFD 引起的体重增加与免疫细胞 ATRAP 表达增加有关。在骨髓移植实验中,与 BM-WT 小鼠相比,BM-KO 小鼠表现出 HFD 引起的体重增加和内脏脂肪扩张的改善,脂肪细胞较小。此外,与 HFD 上的 BM-WT 小鼠相比,HFD 上的 BM-KO 小鼠在白色脂肪组织代谢、炎症、葡萄糖耐受性和胰岛素抵抗方面表现出显着改善。对白色脂肪组织的详细分析表明,通过改善 BM-KO 小鼠脂肪组织中 CD206 + 巨噬细胞的积聚,显着抑制了 HFD 诱导的转化生长因子-β 信号的激活,这是内脏肥胖的关键因素。这一发现为 BM-KO 小鼠在 HFD 上表现出的抗肥胖表型提供了相关机制。最后,单核细胞的转录组分析表明,基因变化(例如单核细胞水平上干扰素-γ 反应的增强)可能会影响 BM-KO 小鼠的巨噬细胞分化。
深度学习衍生的脂肪细胞大小揭示脂肪细胞肥大在遗传控制下
白色脂肪组织的抽象脂肪分布和宏观结构是预测肥胖相关疾病的重要因素,但是探索了白色脂肪组织的细胞微观结构。研究脂肪细胞大小与肥胖相关性状之间的关系以及其潜在的疾病驱动遗传关联,我们进行了最大的自动脂肪细胞表型研究,将组织学测量和遗传学联系起来。我们介绍了基于深度学习的方法,用于对5个独立队列的皮下和内脏脂肪组织组织学样本(n = 2,667)的可扩展和准确的语义分割,包括来自9,000个整个幻灯片图像的数据,超过2700万个脂肪细胞。对Glastonbury等人的脂肪细胞平均大小的估计值进行了验证。2020。我们表明,脂肪细胞肥大与不良代谢曲线相关,瘦素水平升高,空腹血浆葡萄糖,糖化血红蛋白和甘油三酸酯以及脂联蛋白和HDL胆固醇的水平降低。We performed the largest GWAS (N Subcutaneous = 2066, N Visceral = 1878) and subsequent meta-analysis of mean adipocyte area, and find two genome-wide significant loci (rs73184721, rs200047724) associated with increased 95%-quantile adipocyte size in respectively visceral and subcutaneous adipose tissue.通过性别进行分层,在女性中,我们发现两个基因组显着的基因座,一个变体(rs140503338)与皮下脂肪组织中平均脂肪细胞大小增加相关,另一个(rs11656704)与95%Quartile adipocococypose降低相关。引言肥胖是一个快速发展的全球医疗保健问题。患有肥胖症患者的特征是患有多种疾病的风险增加,包括2型糖尿病,冠状动脉疾病,非酒精性脂肪肝疾病(1,2)。最近大规模基因组的大规模基因组结合研究(GWAS),禁食胰岛素水平和2型糖尿病突出了白色脂肪组织作为一种关键组织,其中与疾病相关的变异体现了其作用(3)。
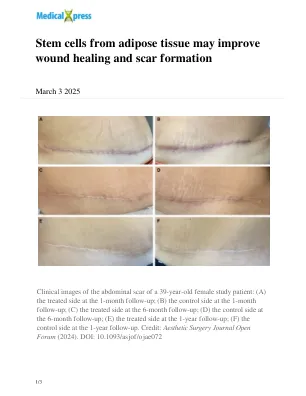
来自脂肪组织的干细胞可能会改善伤口愈合和疤痕形成
“传统上,干细胞主要是从骨髓或脐带血中收获的,都是相对难以获取的来源。在2001年,发现脂肪组织不仅包含脂肪细胞,而且还包含间充质干细胞 - 支持在组织损伤的情况下充当干细胞的细胞。这为干细胞疗法提供了更容易获得的替代方法。从那时起,这些干细胞已被研究并用于各种应用,包括神经系统疾病,骨关节炎,疼痛治疗和伤口愈合。”
引用Murray MM,Fakhouri L,Harpe SE。元I-Insti:在Hibitor给药中的整合酶链转移后的代谢不良事件
有几项研究可用来描述Insti类对体重的影响。对八项临床试验的Art-Ne-Ne-Neive PWH进行了汇总分析,包括超过10,000人年的随访,报道该研究所类别与PIS和NNRTIS相比,体重增加更多。8一项研究比较了1588 PWH启动基于Insti或PI的HIV方案后的体重增加,以进行9.3个月的中位随访。9 PWH开始的Insti的PWH的平均体重增加1.3千克,重量> 5%的PRO部分比启动PI-基于PI-基于PI-GEA的pwh。9的体重增加和BMI在切换到一个没有肥胖症的HIV的1500个WOM EN的研究中,在切换到一个研究中的女性中(有或没有替诺福韦的a fenofovir alafenamide)增加了体重和BMI。10,他改用基于Insti的方案,平均亚us型中央脂肪组织面积增加了约3倍(P = 0.011),并且内脏脂肪组织面积增加了7倍(P <0.001)。11一项现实世界回顾性研究比较了PWH的体重增加,以Darunavir/cobicistat/cobicistat/Emtricitabine/Tenofovir Alafena Mide(n = 452)与PWH中的体重增加,以Bictegravir/Emtricegravir/Emtricegrabine/Tenofofovir Alafecir alafafenamide(n = 497)和重量较大的重量(l Meath in Sport 2) p <0.01)。12
脂肪细胞线粒体:肥胖症和2型糖尿病的脂肪库的解密能量
摘要:脂肪组织是能量平衡的中心参与者,表现出明显的代谢柔韧性,通常在肥胖症和2型糖尿病(T2D)中受到损害。脂肪细胞内的线粒体功能障碍会导致脂质处理效率低下和氧化应激增加,从而共同促进了肥胖及其并发症中心的全身代谢破坏。本评论探讨了线粒体在肥胖和T2D的背景下,线粒体在改变主要脂肪细胞类型(白色,棕色和米色)的代谢功能中所起的关键作用。具体而言,在白色脂肪细胞中,这些功能障碍会导致脂质加工受损和增加的氧化应激负担,从而加剧了代谢性障碍。相反,线粒体功能不受损害,没有其热能能力,从而降低了棕色脂肪细胞中最佳能量消耗的能力。米色脂肪细胞独特地结合了白色和棕色脂肪细胞的功能特性,在适当的刺激下具有帽质脂肪细胞的形态学相似性,同时拥有帽质脂肪细胞,以转化为富含线粒体,能量燃烧的细胞。每种类型的脂肪细胞都会显示出独特的代谢特征,该特征受每种细胞类型的线粒体动力学的控制。这些独特的线粒体代谢表型受包括转录因子,共激活因子和酶的专业网络的调节,这些网络共同确保了细胞能量过程的精确控制。有力的证据表明,在因果关系与肥胖引起的T2D的因果关系中,脂肪细胞线路的代谢和上游调节剂有缺陷。旨在改善脂肪细胞线粒体功能的有针对性干预措施为增强全身性大量营养素氧化提供了有前途的治疗途径,从而可能减轻肥胖症。理解脂肪细胞中线粒体功能的进步强调了打击肥胖和相关合并症的方法的关键转变。重新点燃脂肪组织中卡路里的燃烧,以及其他重要的代谢器官,例如肌肉和肝脏,鉴于脂肪组织在能量储存和释放中的广泛作用至关重要。