XiaoMi-AI文件搜索系统
World File Search System卵形脂质体:免疫反应
摘要一种通常持有的观点是与聚乙烯乙二醇(PEG)共轭的纳米载体是非免疫原性的。然而,许多研究报告说,针对固定的纳米载体发生了意外的免疫反应。一个意外的反应是重复给药后的二甲状纳米载体的快速清除,称为加速血液清除率(ABC)现象。ABC涉及对纳米载体组件的抗体的产生,包括PEG,从而降低了封装的治疗剂的安全性和有效性。另一种免疫反应是称为补体的超敏反应或输注反应(c)激活相关的假伪反应(Carpa)。这种免疫原子和类二载体的不良反应性可能引起了临床使用phe型治疗剂的潜在关注。因此,筛查基于纳米载体的治疗剂的免疫原性和腕面反应生成性应成为先决条件,然后才能进行临床研究。本综述从毒理学的角度提出了质脂质体,PEG的免疫原性,ABC现象,C激活和脂质诱导的鲤鱼,还解决了这些不良相互作用与免疫系统不良相互作用的因素。
脂质体作为一种新型药物输送系统
脂质体是一种微粒胶体囊泡,其中的水介质被一层或多层同心磷脂层包围。亲水性和疏水性药物均可加入其中,水溶性药物被困在水芯中,脂溶性药物被困在磷脂中。它提供控制释放和靶向药物输送,从而增强治疗效果并减少给药频率。几种基于脂质体的药物制剂已获准用于临床,许多正在接受广泛研究。在治疗上,它们被用作药物、病毒、细菌、抗原、肽(抗生素)、疫苗、基因和诊断剂的载体。本综述讨论了脂质体的生产方法和作为靶向和控制输送载体的广泛治疗潜力。
靶向脂质体化疗治疗三重...
简单总结:三阴性乳腺癌 (TNBC) 主要采用标准化疗治疗。联合疗法已被证明是一种有前途的临床治疗策略。本研究的目的是开发一种采用靶向递送载体的联合化疗新剂型。我们发现具有不同抗癌机制的 mertansine 和吉西他滨对 TNBC 细胞具有高细胞毒性。使用两种 TNBC 异种移植模型进行的体内评估证实了抗肿瘤功效,即显著降低了肿瘤生长率。此外,抗体标记的脂质体可有效地将治疗药物递送至 TNBC 肿瘤,从而减少副作用。这项研究具有很高的转化价值,靶向脂质体药物制剂可在未来的 TNBC 治疗临床试验中进一步研究。
载有蛋白酶体抑制剂 Z- 的脂质体...
摘要:结直肠癌 (CRC) 是发达国家癌症相关死亡的主要原因之一。靶向疗法和常规化疗已被开发用于治疗这种恶性癌症。其中,单克隆抗体西妥昔单抗 (Cxm) 和帕尼单抗专门靶向并抑制 ERBB1 (EGF 受体) 的信号传导,ERBB1 是这种癌症发展和进展的关键因素。不幸的是,由于原发性或继发性/获得性耐药性,这些抗体仅对一小部分患者有效。然而,由于 ERBB1 细胞表面表达通常在耐药肿瘤中保持,因此 ERBB1 可用作递送其他药物的靶标。脂质体和免疫脂质体作为药物纳米载体正在接受深入研究,并且可以通过特异性抗体进行功能化。在本研究中,我们首先研究了细胞渗透性三肽亮氨酸-亮氨酸-正亮氨酸 (LLNle)(一种γ-分泌酶和蛋白酶体的抑制剂)在三种表达 ERBB1 的不同 CRC 细胞系中的抗癌活性。我们配制了 LLNle-脂质体和 Cxm 结合的 LLNle 负载脂质体 (LLNle-免疫脂质体),并评估了它们在抑制细胞存活方面的功效。尽管游离 LLNle 和 LLNle-脂质体的促凋亡作用相似,但免疫脂质体-LLNle 的效果明显低于未结合的脂质体。事实上,免疫脂质体-LLNle 很容易被内化并运输到溶酶体,LLNle 很可能在那里被捕获和/或失活。总之,我们证明 LLNle 可以通过脂质体很容易地递送至 CRC 细胞系,但免疫脂质体-LLNle 未能表现出显著的抗癌活性。
叶酸靶向脂质体亚硝基阿霉素
Gazzano, E., Rolando, B., Chegaev, K., Salaroglio, IC, Kopecka, J., Pedrini, I., et al. (2018). 叶酸靶向脂质体亚硝基阿霉素:一种对抗 P 糖蛋白阳性和叶酸受体阳性肿瘤的有效工具。JOURNAL OF CONTROLLED RELEASE, 270, 37-52 [10.1016/j.jconrel.2017.11.042]。
纳米脂质体在癌症治疗中的应用
摘要:用于癌症治疗的药物有许多缺点,因为它们会损害肿瘤和健康细胞,此外,它们往往是难溶性药物。它们在纳米颗粒中的运输可以解决这些问题,因为纳米颗粒可以将药物释放到肿瘤组织中,并提高其溶解度、生物利用度和功效,从而减少其副作用。本文重点介绍纳米技术可以为医学带来的优势,特别强调纳米脂质体。为此,对用于治疗癌症的市售纳米脂质体系统以及处于研究阶段的系统进行了回顾,重点介绍了正在进行的临床试验。研究的所有市售脂质体都是静脉注射的,与非脂质体形式相比,其副作用强度较低。阿霉素是最常用的活性成分。正在进行的临床试验扩大了脂质体药物的可用性,具有新的临床适应症。总之,将药物引入纳米脂质体意味着药物疗效和患者生活质量的提高。未来的研究重点可能是利用新型抗癌药物、不同类型的现有药物或易于转化为工业规模的新标准化方法开发多功能靶向纳米脂质体。
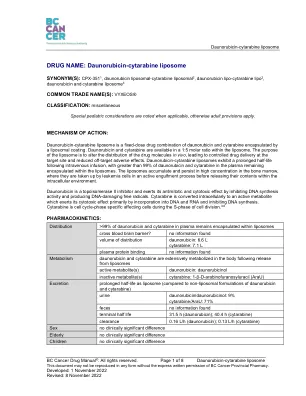
药物名称:柔红霉素-阿糖胞苷脂质体
柔红霉素-阿糖胞苷脂质体是柔红霉素和阿糖胞苷的固定剂量药物组合,被脂质体涂层包裹。柔红霉素和阿糖胞苷在脂质体中的摩尔比为 1:5。脂质体的目的是改变体内药物分子的分布,从而控制药物在靶位的输送,并减少脱靶副作用。柔红霉素-阿糖胞苷脂质体在静脉输注后半衰期延长,血浆中超过 99% 的柔红霉素和阿糖胞苷仍被包裹在脂质体中。脂质体在骨髓中积聚并保持高浓度,在那里,它们被白血病细胞通过主动吞噬过程吸收,然后在细胞内环境中释放其内容物。柔红霉素是一种拓扑异构酶 II 抑制剂,通过抑制 DNA 合成活性和产生破坏 DNA 的自由基发挥其抗有丝分裂和细胞毒性作用。阿糖胞苷在细胞内转化为活性代谢物,其主要通过掺入 DNA 和 RNA 并抑制 DNA 合成来发挥其细胞毒性作用。阿糖胞苷是细胞周期阶段特异性的,在细胞分裂的 S 期影响细胞。3-6
脂质体共聚焦重塑肿瘤微环境...
在图 (A)、(C) 和 (E) 中呈现。在图 (B)、(D) 和 (F) 中呈现了各种治疗后的 AUTC。对照组 - LCL 治疗组;SIM - 用 5 mg/kg 游离 SIM 处理的实验组;LCL-SIM - 用 5 mg/kg 脂质体包封的 SIM 处理的实验组;DMXAA - 用 14 mg/kg 游离 DMXAA 处理的实验组;LCL-DMXAA - 用 14 mg/kg 脂质体包封的 DMXAA 处理的实验组;SIM+DMXAA - 用 5 mg/kg 游离 SIM 和 14 mg/kg 游离 DMXAA 处理的实验组;LCL-SIM + LCL-DMXAA - 用 5 mg/kg SIM 和 14 mg/kg DMXAA 脂质体包封形式处理的实验组。结果表示为 5 只小鼠的肿瘤体积的平均值±SD。采用单因素方差分析检验并进行 Bonferroni 校正进行多重比较,以分析不同治疗对肿瘤生长的影响之间的差异(ns,P >0.05;*,P <0.05;**,P <0.01;***,P <0.001)。