XiaoMi-AI文件搜索系统
World File Search SystemIQ亚型,大脑体积和免疫标记
当前的化学测试策略的检测能力有限,其检测非生物毒性致癌物(NGTXC)的能力受到限制。表观遗传异常在癌变期间发生,无论分子启动事件是否与遗传毒性(GTXC)或NGTXC事件有关;因此,可以利用表观遗传标记来开发新的方法方法,以改善两种类型的致癌物的检测。这项研究使用叙利亚仓鼠胎儿细胞来建立致癌物诱导的DNA甲基化从原代细胞变化,直到衰老 - 衰老,这是必不可少的致癌步骤。将暴露于溶剂对照7天的细胞与幼稚的原发性培养物进行了比较,与苯并[a] pyrene暴露了7天的细胞,以及随后转化阶段的细胞:正常菌落,形态转化的菌落,衰老,衰老,衰老,bypass和持续的扩散。DNA甲基化变化通过降低的代表性亚硫酸盐测序在第7天最少。在细胞衰老过程中产生了深刻的DNA甲基化变化,其中一些早期差异甲基化区域(DMR)通过最终的持续性促进阶段保留。通过Pyrosequencing验证了一组这些DMR(例如POU4F1,AIFM3,B3GALNT2,BHLHE22,GJA8,KLF17和L1L),并通过Pyrosequencing验证,并在从不同的实验室中获得的多个克隆中证实了它们的可重复性。这些DNA甲基化变化可以用作生物标志物,以增强对细胞转化的客观性和机械理解,并可用于预测衰老 - 肿瘤和化学致癌性。
11. 制药技术百科全书,第三版
第 1 卷 21 CFR 第 11 部分回顾 / 1 吸收促进剂 / 13 药物吸收 / 19 固体表面吸附:制药应用 / 34 药物不良反应 / 46 处方药和非处方药产品的广告和促销 / 57 替代药物 / 66 无定形制药系统 / 83 分析程序:验证 / 92 药物开发中的动物 / 114 无菌处理:验证 / 127 自氧化和抗氧化剂 / 139 生物可吸收聚合物 / 155 药物的生物利用度和生物等效性 / 164 可生物降解聚合物作为药物载体 / 176 生物液体:分析 / 194 生物药剂学 / 208 药物的生物合成 / 228 生物技术和生物制剂 / 258生物技术衍生的药物产品:配方开发 / 281 生物技术衍生的药物产品:稳定性测试、灌装和包装 / 302 药物的生物转化 / 310 蒸汽灭菌的生物验证 / 325 血液替代品:氟碳方法 / 335 血液替代品:基于血红蛋白的氧载体 / 353 吹灌封:高级无菌处理 / 378 缓冲剂、缓冲剂和离子平衡 / 385 药物研发中的量热法 / 393 硬胶囊 / 406 软胶囊 / 419 致癌性测试:过去、现在和未来 / 431 手性分析方法 / 445 色谱分析方法:气相色谱法 / 463 色谱分析方法:高效液相色谱法
从环境中分离出的颜料产生的微生物及其抗菌活性
摘要。在食品行业中,总是有对色彩鲜艳,外观吸引人的食品的需求,并且具有营养和健康增强的特性,以吸引消费者的注意。合成色素被广泛用于全球市场,但是它们可能引起许多副作用,例如高过敏性,致癌性和其他毒理学问题。最近的研究表明,微生物是自然色的丰富来源,可以使工业生产安全,环保的生物降解色素。这项工作的目的是将色素微生物从环境样品中分离出来,选择的发酵条件,从微生物中分离色素并检查其抗菌活性。颜料已经从各种来源分离出来,例如土壤,食物浪费,面粉等。生长生产微生物的生长参数,例如生长温度,pH,类酮和NaCl浓度,以评估色素的产生。发酵后,用超声浴和溶剂提取通过细胞裂解来分离五种类型的色素。研究了提取的色素的抗菌活性。在研究期间,确定了微生物生长的最佳条件:温度为30°C,pH 7,浓度为3%胰蛋白酶和6%NaCl。甘油被发现是一种额外的碳源,对色素产生产生积极影响。粉红色的色素对测试的致病细菌表现出最高的抗菌活性。提取的颜料的抗菌作用结果表明,铜绿假单胞菌对颜料的作用最敏感。关键词:色素,微生物,隔离,发酵。
药品名称:Selpercatinib
警告: • 严重肝功能不全(Child-Pugh C)患者需要减少起始剂量并更频繁地监测 AST/ALT 2,3 • 在开始治疗前应充分控制已有的高血压 2,3 • 可能需要减少 selpercatinib 剂量以应对涉及 CYP 3A4 代谢途径的药物相互作用 2,3 • 据报道 QTc 延长;在治疗前纠正电解质异常并监测已知风险因素患者的心电图和电解质 2,3 • selpercatinib 与伤口愈合受损和出血有关;接受外科手术的患者可能需要停止使用 selpercatinib 2,3 • 肿瘤负担高、肿瘤快速生长、肾功能不全或脱水的患者可能会增加肿瘤溶解综合征的风险 2 特殊人群:如果使用 selpercatinib 治疗,生长板开放的儿科患者可能会增加生长迟缓的风险。在幼年动物研究中,观察到骨骺生长板肥大、股骨长度减少、骨矿物质密度降低和牙齿异常(例如牙齿发育不良、牙齿变色和错颌畸形)。有些影响是不可逆的。监测开放生长板患者的生长板异常。2 致癌性:尚未进行致癌性研究。2,3 致突变性:在 Ames 试验中无致突变性。Selpercatinib 在哺乳动物体内染色体试验中具有致染色体断裂作用,但在哺乳动物体外染色体试验中无致染色体断裂作用。2,3 生育力:在动物研究中,雄性受试者在暴露量低于人类临床暴露量时表现出睾丸退化、附睾腔内精子减少、剂量依赖性睾丸生殖细胞耗竭和精子细胞滞留。在暴露量约为预期人类临床暴露量的两倍时观察到精子形态的改变。当未成年雄性受试者后来在青春期与未经治疗的雌性交配时,生殖能力也会受到影响。观察到的影响包括:雄性生育力和交配指数降低、着床前和着床后损失增加、可存活胚胎减少。在雌性受试者中,发情周期数减少,可存活胚胎减少,着床后损失增加,暴露程度与人类临床暴露后相似。据报道,暴露程度低于人类临床暴露后,黄体减少或缺失,以及黄体囊肿存在。2,3 Selpercatinib 可能会损害有生育能力的男性和女性的生育能力。2 怀孕:在动物研究中,selpercatinib 具有致畸性并导致胚胎胎儿毒性。在类似或更高的暴露水平下,观察到结构畸形、早期吸收、胎儿体重下降、着床后损失增加和存活胎儿减少。比人类临床暴露后观察到的要多。2 建议在开始治疗前对有生育能力的女性患者进行妊娠测试。建议在治疗期间以及最后一次服用 selpercatinib 后至少 2 周内对有生育能力的女性患者和有生育能力的女性伴侣的男性患者进行避孕。2 由于可能分泌到乳汁中,因此不建议母乳喂养。女性在治疗期间以及最后一次服用 selpercatinib 后 2 周内不应母乳喂养。2
药物名称:pralsetinib
注意:•涉及P-gp转运蛋白和/或CYP 3A代谢途径的药物相互作用可能需要调整Pralsetinib剂量调整3,4•在开始治疗之前应充分控制预先存在的高血压。接受外科手术的患者中扣留pralsetinib 3•肿瘤负担高,肿瘤快速生长,肾功能障碍或脱水的患者可能会增加患肿瘤裂解综合征3的风险3•QTC延长案件均已报告;如有已知危险因素的患者6特殊人群:不建议在12岁以下的儿童中建议使用Prastetinib,并监测治疗前正确的电解质异常,并监测ECG和电解质。在动物研究中,在与人类临床暴露后预期的暴露相似的暴露时观察到骨骼和牙齿异常(包括股骨的物理发育不良,胸骨的物理厚度增加,门牙变性和牙齿坏死)。某些效果是不可逆转的。监测开放式生长板的青春期患者的生长板异常。考虑基于任何报告异常的严重程度中断或中断治疗。4致癌性:尚未进行致癌性研究。3诱变性:在AMES测试中不是诱变。pralsetinib在体内和体外染色体测试中并非层生成。在一项专门的生育研究中,将男性和女性测试受试者用pralsetinib治疗并彼此交配时,对交配表现或受孕能力没有明显的影响。3,43生育能力:在动物毒理学研究中,在与人类临床暴露后看到的暴露相似,包括睾丸/附子体重降低,睾丸肾小管变性和乳脂型乳液变性。然而,有82%的女性研究受试者完全吸收了垃圾,植入后92%的垃圾损失约为临床剂量预期的人类暴露的0.35倍。与未经治疗的雌性交配时,没有明显的pralsetinib对男性生殖性能或胚胎内胚胎内生存的影响,其剂量的剂量约为临床剂量预期的人类暴露的1.7倍。3,4妊娠:在动物研究中,在器官发生过程中的促甲替尼在临床剂量下的预期人类暴露时会导致致病性和胚胎性。当pralsetinib的剂量水平约为临床剂量时预期的人类暴露的1.8倍时,观察到植入后100%。内脏和骨骼畸形(例如,缺乏输尿管,肾脏不正确,椎骨异常和骨化降低)在暴露时观察到约0.2倍于临床剂量的预期人类暴露。在开始对育儿潜力的女性患者开始治疗之前,建议进行妊娠试验。非荷尔蒙避孕方法,并在最后剂量后至少两周,为女性生育潜力的女性患者使用避孕方法。激素方法,因为pralsetinib可能会降低激素避孕药的功效。对于具有生育潜力的女性伴侣的男性患者,建议在治疗期间和最后一剂pralsetinib后至少一周。3,4不建议母乳喂养,因为对母乳的潜在分泌。女性在治疗期间不应母乳喂养,在上一剂pralsetinib后的一个星期内不应母乳喂养。
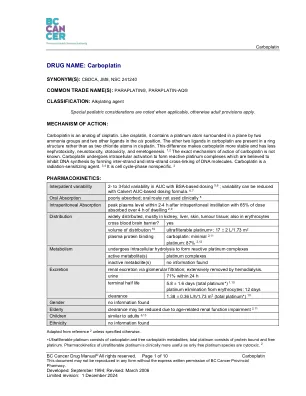
药物名称:卡铂
特别注意事项:禁忌症:• 有卡铂、其他铂类药物(如顺铂)或甘露醇 12 的过敏反应史(每个制造商);但是,一些对卡铂过敏的患者可以接受再次使用卡铂或在采取适当预防措施的情况下改用顺铂 2,15,16 警告:• 先前接触顺铂会增加毒性的风险和严重程度(例如骨髓抑制、恶心、呕吐、周围神经病变、耳毒性)12 特殊人群(老年病学):65 岁以上的患者周围神经病变的发病率增加,骨髓抑制可能更严重。此外,老年患者更容易出现与年龄相关的肾功能障碍,这可能需要减少剂量并仔细监测血细胞计数。 2,11 致癌性:使用卡铂治疗数年后,曾报告出现急性早幼粒细胞白血病和骨髓增生异常综合征/急性髓细胞白血病。17 致突变性:体外研究表明,卡铂具有致突变性。17 生育能力:卡铂可能导致患者出现性腺抑制(如闭经、无精子症),这通常与治疗剂量和治疗时间有关,并且可能是不可逆的。动物研究报告了明显的卵巢萎缩。如果适用,应考虑在治疗前保留生育能力。17 怀孕:动物研究显示,卡铂具有胚胎毒性和致畸性。对于有生育能力的女性患者,建议在治疗期间以及治疗结束后至少 7 个月内避孕。对于有生育能力的女性伴侣的男性患者,建议在治疗期间以及治疗结束后至少 4 个月内避孕。18
unit-3 - 能源存储
镍镉系统使用与镍铁系统相同的正极和电解质,并结合金属镉负极。电池反应如表 10.1 所示,其标称开路电压为 1.3 V。从历史上看,电池的发展与镍铁的发展同步,性能相似。镍镉技术因具有高比功率(超过 220 W/kg)、长循环寿命(高达 2000 次循环)、高电气和机械滥用耐受性、宽放电电流范围内电压降小、快速充电能力(18 分钟内约 40% 至 80%)、宽工作温度范围(-40 至 85°C)、低自放电率(<0.5%/天)、由于腐蚀可忽略不计而具有出色的长期储存性能以及多种尺寸设计等优点而取得了巨大的技术进步。然而,镍镉电池也存在一些缺点,包括初始成本高、电池电压相对较低以及镉的致癌性和环境危害。镍镉电池通常可分为两大类,即通风型和密封型。通风型有许多替代品。通风烧结板是较新的发展,具有较高的比能,但价格较贵。它的特点是放电电压曲线平坦,大电流速率和低温性能优越。密封镍镉电池采用特定的电池设计特点,可防止过度充电期间因气体产生而导致电池内压力积聚。因此,该电池无需维护。EV 和 HEV 配置的镍镉电池的主要制造商是 SAFT 和 VARTA。最近采用镍镉电池供电的电动汽车包括克莱斯勒 TE Van、雪铁龙 AX、马自达 Roadster、三菱 EV、标致 106 和雷诺 Clio。
免疫逃避机制的激活是人类细胞恶性转化过程的一部分
人类细胞的恶性转化与它们的重新编程有关,这导致了不受控制的增殖,并在同一时间的生化途径的生化激活形成了癌症免疫逃避机制。然而,没有概念上的理解,即免疫逃避的途径和免疫检查点蛋白的表达是否构成了恶性转化过程的一部分,或者它们是否是由试图攻击正在遭受过这种情况下或已经发生恶性转化的细胞的T淋巴细胞和天然杀手(NK)触发的。为了解决这个基本问题,我们使用包含称为ptaquiloside的致癌性碱基的铜提取物对BEAS-2B人支气管上皮细胞和RC-124非恶性的人肾细胞进行实验性恶性转化。这种转化导致细胞增殖速度的显着上调,同时导致了关键免疫检查点蛋白的表达显着上调 - galectin-9,编程死亡配体1(PD-L1),indoleamine 2,3-二氧酶(IDO1)。它们的表达水平的增加与HIF-1转录复合物的水平和活性以及转化生长因子β型1(TGF-β)-SMAD3信号通路的水平和活性一致。与T细胞共培养时,与原始的非转化细胞相比,转化的上皮细胞显示出更高,更有效的免疫逃避活性。因此,这项工作解决了一个非常重要的科学和临床问题,并建议在人类细胞的恶性转化过程中激活癌症免疫逃避机制,无论微环境中存在免疫细胞。
博路定产品专论
在对小鼠和大鼠进行的两年恩替卡韦致癌性研究中,发现了阳性致癌结果。在雄性小鼠中,当暴露量≥人类 1 毫克暴露量的 3 倍时,观察到肺腺瘤发生率增加,在雄性和雌性小鼠中,当暴露量约为人类 1 毫克暴露量的 40 倍时,观察到肺癌。肿瘤发展之前,肺中会出现肺细胞增殖,而在服用恩替卡韦的大鼠、狗或猴子中则未观察到这种现象,这表明在小鼠中观察到的肺肿瘤发展的关键事件可能具有物种特异性。在最高剂量的恩替卡韦暴露量下(小鼠剂量约为人类暴露量的 40 倍,大鼠剂量约为人类暴露量的 35 倍(雄性)和 24 倍(雌性),)观察到与药物相关的其他类型肿瘤发生率增加,包括雄性小鼠的肝癌、雌性小鼠的良性血管肿瘤、雄性和雌性大鼠的脑小胶质细胞肿瘤以及雌性大鼠的肝腺瘤和肝癌。在高剂量(0.4 mg/kg/天;相当于人类 1 mg 暴露量的 4 倍)和最高剂量(2.6 mg/kg/天;相当于人类 1 mg 暴露量的 24 倍)下,雌性大鼠均观察到皮肤纤维瘤。(有关详细信息,请参阅毒理学、致癌作用、诱变作用、生育能力受损)。
药品名称:达克替尼
特殊人群:• 女性、非亚裔或65岁或以上的患者可能比其他患者经历更严重的不良事件。2 致癌性:未发现信息 致突变性:Ames 试验中无致突变性。达克替尼在哺乳动物体内染色体试验中不具有致染色体断裂作用。哺乳动物体外染色体试验的结果相互矛盾。2,4 生育力:已证实暴露于 EGFR 抑制剂的动物会出现植入前丢失。在动物研究中,雌性受试者在暴露于达克替尼人类治疗暴露量的 0.3 倍时出现可逆性的宫颈和阴道上皮萎缩。在男性受试者中,据报道,在暴露于达克替尼人类治疗暴露量的 0.6 倍时出现可逆性的前列腺分泌减少。2-4 妊娠:基于其作用机制,达克替尼预计会对胎儿造成伤害。在动物模型中,EGFR 信号通路中断与胚胎-胎儿毒性有关(例如,胎儿丢失增加、出生后死亡、发育异常和内脏异常)。动物研究中的怀孕受试者经历了母体体重增加减少、胎儿体重减轻和植入后丢失增加。育龄女性和有育龄女性伴侣的男性应在服用达克替尼期间以及停止治疗后至少两个月内采取有效的避孕措施。2,3 不建议母乳喂养,因为达克替尼可能会分泌到乳汁中。女性应在服用最后一剂达克替尼后至少等待两个月才能进行母乳喂养。2