XiaoMi-AI文件搜索系统
World File Search System
1900-01-01
机构名称:
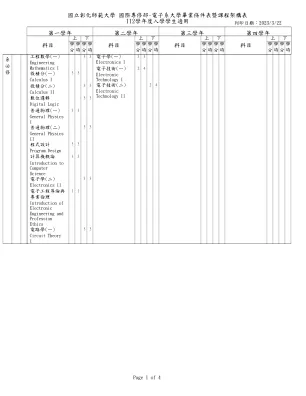
112学年度入学学生适用...
可穿戴系统设计组合语言33 3组装语言线性代数3 3线性代数讯号与系统3 3信号和系统资料结构33 3数据结构近代物理33 3 3 3 3 3 3 3 3 3
2009-10-16
机构名称:
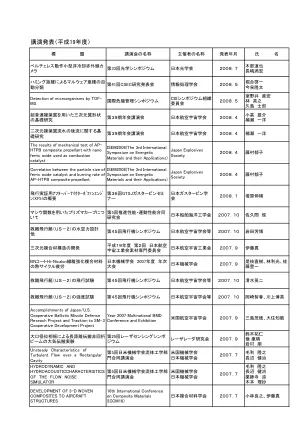
演讲发表 (2007) - 国防部
烟气风洞中双翼机翼升力系数的初步研究 第 46 届 AIAA 航空科学会议及展览 AIAA (美国航空航天学会) 2008.1 Kazuhiro Kusunoki
2013-05-14
机构名称:
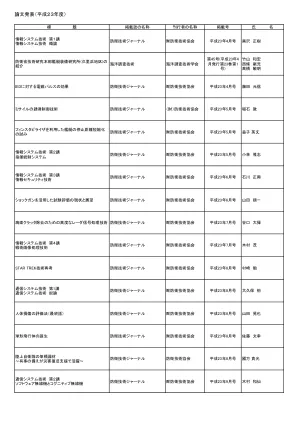
论文发表(2011 财年)- 国防部
使用弯曲压电盘的 Tonpilz 压电换能器的频率特性估计 Applied Acoustics Elsevier 第 72 卷,第 12 期,2011 年 12 月 Tomonao Okuyama Kenji Saijo
2025-01-12
机构名称:
物理年会议程总表Detailed Meeting Agenda
09:30 ~ 09:45 Germar Hoffmann Sunao Shimizu Yu-Wei Chen Ravish Kumar Jain YingLin Li Yu Hung Lin JaYil Lee Yan-Ru Chen Chan-Ching Lien Saikat Karmakar Po-Feng Wu Amar Aryan Chen-Kang Huang Hsin-Yeh Wu Chin-Chia Wu Anli Tsai
2022-01-18
机构名称:
32 位和 64 位的实现...
Chipyard 是一个使用敏捷团队设计和评估全系统硬件的框架。它由一系列工具和库组成,旨在为片上系统开发提供开源和商业工具之间的集成。[来源:Chipyard]