XiaoMi-AI文件搜索系统
World File Search Systemβ-位位标记的定性和定量分析...
抽象的山茶花油和具有优势经济价值的橄榄油很容易被其他更便宜的油掺杂。由于其相似的脂肪酸剖面,很难通过传统方法识别这两种油。在本研究中,开发了一种使用GC/MS和GC/FID对β-羟溶酶溶质分析的新型方法,以鉴定茶油和橄榄油。β-溶解质分析的方法验证显示出良好的线性和令人满意的值,可恢复,准确性,精度和可重复性。校准曲线的线性回归系数(R 2)为0.9985。达到了可接受的检测极限(0.36 mg/100 g)和定量极限(1.20 mg/100 g)。尖刺的后期为95.0%至100.3%。日期精度的相对标准偏差(RSD)小于3.26%,可重复性的保留时间和峰面积的RSD分别在0.03%和1.08%之内。分别在14.1–30.2 mg/100 g和94.3–173.2 mg/100 g的含量为14.1–30.2 mg/100 g和94.3–173.2 mg/100 g的范围内,这表明前者的β-塞托蛋白含量是后者的七次,并且在后者和β-硫代蛋白固醇中都可以验证。 关键词:β-中证醇;维珍山茶花油(VCO);原始橄榄油(VOO);定性分析;定量分析。分别在14.1–30.2 mg/100 g和94.3–173.2 mg/100 g的含量为14.1–30.2 mg/100 g和94.3–173.2 mg/100 g的范围内,这表明前者的β-塞托蛋白含量是后者的七次,并且在后者和β-硫代蛋白固醇中都可以验证。关键词:β-中证醇;维珍山茶花油(VCO);原始橄榄油(VOO);定性分析;定量分析。
哲学硕⼠学位(微电⼦学)课程及理学...
修读“项⽬报告”,以获得,以获得21学“实习及报告”,的学⽣须修读以下八⾨选修学科单元/科⽬,以获,以获24学分︰453 3数字集成电路453数据转换器集成电路设计453数据转换器集成电路设计453数据转换器集成电路设计453柔性交流输电系统453 3柔性交流输电系统453电源管理集成电路设计453 45 3 3⽣物医学⼯程专题453⽣物医学⼯程专题453 3
2024科学与工程学院毕业论文介绍
实验室名称1富士实验室2山摩托实验室3山原实验室4萨萨哈拉实验室5木马实验室6 Murata实验室7 Murata实验室8 Kawabata Laboratory 9 Kawabata实验室9 Okubo实验室10 Shibuo Laboratory 10 Shibuo实验室实验室11 Matsuoka Laboratory 12 Yamada Laboratory 13 YAMADA Laboratory 14 Okub sheratory 14 Okuubi fujiuchi 14 o实验室18 SASA实验室19 Shibuo实验室20 Noguchi实验室21 Fujiuchi Laboratory 22 Kawabata Laboratory 23 SASA实验室23 SASA实验室24 Noguchi Laboratory 25 Shibuo实验室25 Shibuo实验室26 IWAI实验室27 SASA实验室27 Sasa Laboratory 28 Kawabata Labotoration 28 Kawabata实验室29 Haseguchi Laguchi Laguchi Laboratory 30 Noguchi Laboratory 31 Noguchi Laboration 31 31 Murata实验室32 Fujiuchi实验室33 Yamada Laboratory 34 Fujiuchi Laboratory 35 Sakamoto Laboratory 36 SASA实验室37 Hasegawa Laboratory 38 Hasegawa Laboratory
靶向实体瘤中的trop2:查看结构和新表位
滋养细胞表面抗原2(Trop2)在正常组织中表现有限,但在各种实体瘤中表现过过表达。抗Trop2抗体 - 药物结合物(ADC)在管理乳腺癌中的有效性将Trop2验证为癌症治疗的有前途的治疗靶点。但是,过度的毒性和低反应率构成了持续的挑战。应为Trop2阳性癌症制定更安全,更有效的策略。trop2的动态结构属性和寡聚组件具有强大的障碍,以对创新的靶向疗法的发展。在这篇综述中,我们总结了理解Trop2结构的最新进步,并概述了Trop2靶向剂的表位特征。此外,我们讨论了抗Trop2代理的表位及其各自的功能之间的相关性,特别是强调其在靶向疗法中的效率和特定性。
HIV-1 候选疫苗的设计和表征,以引发针对多个表位的抗体
设计和表征 HIV-1 候选疫苗以引发针对多个表位的抗体 Harry B. Gristick 1 、Harald Hartweger 2 、Yoshiaki Nishimura 3 、Edem Gavor 1 、Kaito Nagashima 1 、Nicholas S. Koranda 1 、Priyanthi NP Gnanapragasam 1 、Leesa M. Kakutani 1 、Luisa Segovia 1 、Olivia Donau 3 、Jennifer R. Keeffe 1 、Anthony P. West, Jr. 1 、Malcolm A. Martin 3 、Michel C. Nussenzweig 2,4 、Pamela J. Bjorkman 1,* 1 加州理工学院生物学和生物工程部,美国加利福尼亚州帕萨迪纳市 2 洛克菲勒大学分子免疫学实验室,美国纽约州纽约 10065 3美国马里兰州贝塞斯达市国立卫生研究院国家过敏和感染性疾病研究所分子微生物学系。4 洛克菲勒大学霍华德休斯医学研究所,纽约州纽约市 10065,美国
Tau 靶向抗体疗法:太晚了、错误的表位还是错误的靶标?
参考文献 (1) Golbe, LI 和 Ohman-Strickland, PA 进行性核上性麻痹的临床评定量表。Brain 130, 1552-1565 (2007)。 (2) Dam, T. 等人。单克隆抗 tau 抗体 Gosuranemab 在进行性核上性麻痹中的安全性和有效性:PASSPORT 试验。Nat Medicine X, XX (2021)。 (3) Hoglinger, GU 等人。tilavonemab 在进行性核上性麻痹中的安全性和有效性:一项 2 期随机安慰剂对照试验。Lancet Neurology 20, 182-192 (2021)。 (4) Jadhav, S. 等人。tau 治疗策略概述。Acta Neuropathol Commun. 7, 22 (2019)。 (5) Sopko, R. 等人。 gosuranemab 表征 tau 结合。Neurobiol Dis。146, 105120 (2020)。(6) Yanamandra, K., 等人。抗 tau 抗体可降低不溶性 tau 并减少脑萎缩。Ann Clin Transl Neurol。2, 278-288 (2015)。(7) Kim, B., 等人。Tau 免疫疗法与 FTLD-tau 中的神经胶质反应有关。Acta Neuropathol。doi:10.1007/s00401-021-02318-y。提前在线 (2021)。(8) Jabbari, E., 等人。TRIM11 基因座的变异改变了进行性核上性麻痹表型。Ann Neurol。84, 485-496 (2018)。 (9) Biogen 在阿尔茨海默氏症试验阴性后暂停 Gosuranemab 的治疗。https://www.alzforum.org/news/research-news/biogen-shelves-gosuranemab-after-negative- alzheimers-trial (2021)。(10) Jabbari, E., 等人。进行性核上性麻痹生存的遗传决定因素:全基因组关联研究。柳叶刀神经病学 20, 107-116 (2021)。(11) Evans LD、Strano A、Campbell A 等人。全基因组 CRISPR 筛选确定 LRRK2 调节的内吞作用是人类神经元摄取细胞外 tau 的主要机制。预印本网址为 https://www.biorxiv.org/content/10.1101/2020.08.11.246363v1 (2020)。 (12)Myeku,N.,等人。Tau 驱动的 26S 蛋白酶体损伤和认知功能障碍可能是
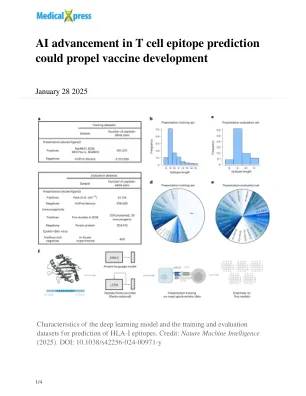
T 细胞表位预测中的 AI 进步或将推动疫苗开发
该团队由共同第一作者 Jeremy Wohlwend 博士和 Anusha Nathan 博士领导,通过结合 Gaiha 实验室在 T 细胞免疫学方面的专业知识和 Barzilay 实验室在人工智能方面的开创性工作,力求解决疫苗开发中长期存在的挑战:快速准确地识别外来病原体中的 T 细胞表位。表位是抗原的特定区域,可被人体免疫细胞识别,对激活靶向免疫反应至关重要。
甲状腺球蛋白抗体和肿瘤表位特异性细胞免疫在乳头状甲状腺癌中
乳头状甲状腺癌(PTC)的特征是T细胞及过滤,并且经常以抗硫代表球蛋白抗体(TGAB)的存在。在这种情况下,细胞免疫和TBAB的作用是争论的问题。我们研究的目的是将TGAB,肿瘤表位特异性T细胞的存在与PTC患者的临床结果相关联。我们研究了n = 183例诊断为PTC的患者,这些患者接受了总甲状腺切除术和131 I消融治疗。在平均97个月的随访期间,大多数PTC患者没有肿瘤复发的迹象(n = 157例)。相反,一名患者的血清TG水平高于检测极限,<1 ng/mL,两个患者TG血清水平≥1ng/ml和<2 ng/ml,n = 23例患者的Tg血清水平≥2ng/ml。在14例患者中看到了肿瘤复发的形态迹象。所有这些患者的血清TG水平≥2ng/mL。重要的是,除一名患者外,所有TGAB阳性PTC患者(n = 27)没有肿瘤复发的迹象,因为血清TG水平低于该测定功能敏感性。四聚体分析显示。总而言之,我们表明TGAB的发生可能会影响PTC患者的临床结果。这可能是由于PTC患者的肿瘤表位特异性细胞免疫。
优秀発表赏エントリー演题
(1个农业和生命科学研究生院,东京大学)[目的]近年来,由于人们担心能源和食物自给自足的减少以及全球变暖,进口资源的兴起以及Yen的弱点,可持续生物量作物引起了人们的关注。生物量作物不仅用作生物产品的原材料,而且还用作饲料。在这项研究中,使用基因组编辑技术生产了“非盛大的大米”,其用途是通过测量其户外培养,生物量和可溶性糖和淀粉含量来评估作为生物质和饲料作物的。 [材料和方法]具有栽培的水稻品种“ koshihikari”,这是一种双突变体(去除异国基因),florogen基因和㻴ニ㻟ニックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロックロック这种突变抑制了开花,但是通过自我产生异态性的个体,突变体系统得以维持。此外,使用该双重突变体在背景中,使用一种技术在茎和茎中涉及糖和淀粉代谢的技术创建了参与茎和叶中糖和淀粉代谢的基因的突变。在户外培养这些基因组编辑系统时,他们已提前向教育,文化,体育,科学和技术咨询,并提交了一项实验计划,以便接受它们。每个突变体的收获分为黄色成熟期(从㻟㻜㻜㻠㻜㻜㻜㻜㻜㻜㻜㻜です),这是普通饲料水稻品种的收获期,黄色成熟期后约几周。除了测量收获个体的干重外,还从代表性的分er中测量了每个器官中可溶性糖和淀粉的浓度,并估计每个器官的产量。此外,测量了整个收获个体的可溶性糖和淀粉的浓度,并计算每个个体的可溶性糖和淀粉的重量。 [结果和讨论]收集了每个菌株(゚㻩ン),并测量其干重,结果表明,在黄色成熟期间收获的koshihikari是㻟㻜±㻤㻌ランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドラ㻤㻌ランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドラ㻟㻜±㻤㻌ランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドランドラ-riptherore,黄色成熟期后收获的干重是㻣㻣±㻝㻌ラック㻝㻌ラック±㻝㻌ラック,并且对非透性突变剂的生物量显着增加。此外,根据代表性耕种器的每个器官的可溶性糖浓度计算估计的产率,结果表明,Koshihikari大约是㻜㻚㻠㻛ロックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセックセック的,另一方面,估计的淀粉产量大约是㻞㻚㻞㻌㻌㻌㻠ラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドラインドライン进一步,目前正在测量每个菌株的溶剂糖和淀粉的重量。此外,我们将报道在不开放的菌株中涉及糖和淀粉代谢的基因中引入突变的菌株的分析结果。以上结果表明,非灌木菌株中生物量显着增加,茎和叶片中可溶性糖和淀粉的显着积累,表明不明显的koshihikari大米植物作为高生物量的水稻品种的有用性。此外,它被认为是饲料稻的非常有用的,因为它在喂养牛时不包含高度未消除的稻田。此外,为了实施“脸红的大米”血统,该公司还致力于开发技术,以选择不以种子表型为指标从单独群体中开花的个人。