XiaoMi-AI文件搜索系统
World File Search System番茄果实成熟的表观遗传调控
果实作为被子植物特有的器官,为人类提供丰富的膳食纤维、维生素等营养物质,是健康膳食结构的重要组成部分(Giovannoni,2001;Chen et al.,2020)。果实成熟是果实食用品质形成的关键时期,是一个涉及果实质地变化、色素积累、香气和风味物质形成、抗性降低等性状的复杂发育过程,受诸多内外部因素的调控(Giovannoni,2004;Ji and Wang,2023)。内外部因素主要有转录因子和激素等,外外部因素主要有各种生物因素和非生物因素。根据呼吸模式的不同,果实可分为跃变型和非跃变型两类(Mcmurchie et al.,1972)。在果实成熟过程中,呼吸强度和乙烯释放量出现伴随爆发,如番茄、苹果和香蕉等,而非呼吸强度和乙烯释放量变化不显著,如草莓、葡萄、柑橘等( Shinozaki et al.,2018 )。乙烯生物合成的两个系统(系统I和系统II)在果实发育和成熟过程中起着至关重要的作用。未成熟的果实和植物其他器官持续产生低浓度的乙烯,即乙烯背景浓度。系统I乙烯以负反馈方式调节背景浓度的乙烯合成并参与果实发育,系统II乙烯以负反馈方式产生。
表观遗传药物和免疫检查点抑制剂
表观遗传机制是影响基因表达和细胞功能的过程,而无需涉及DNA序列的变化。表观遗传学调节的基因的这种异常或不稳定的表达会引发癌症和其他各种疾病。参与抗肿瘤反应的免疫细胞和肿瘤的免疫原性也可能受到表观基因组变化的影响。这对癌症免疫疗法,表观遗传疗法及其在针对癌症中的联合治疗的发展和应用具有显着意义。我们提供了最近的研究文献概述,重点介绍了免疫细胞中表观基因组的变化如何影响免疫细胞的行为和功能以及癌细胞的免疫原性。以及对关注免疫检查点分子的免疫检查点抑制剂的表观遗传药物的联合利用[例如,程序性死亡1(PD-1),细胞毒性T-淋巴细胞相关蛋白4(CTLA-4),T细胞免疫球蛋白和Mimunoglobulin and Mucunain(Tim-3),tim-3) (lag-3)]存在于与肿瘤相关的免疫细胞和基质细胞中。我们强调了针对表观遗传调节剂扩增抗肿瘤免疫反应的小分子抑制剂的潜力。此外,我们讨论了如何利用癌症表观遗传学与癌症免疫学之间的复杂关系,以创建将表观遗传疗法与免疫疗法相结合的治疗方案。
PD-1抑制剂在MSS/PMMR转移性结肠癌中结合放疗和GM-CSF:病例报告 COVID-19中的细胞免疫力以及共同可变免疫差的其他感染 DNA分子在自然界中的应用 谁以及如何,网络驱动的炎症中的DNA传感器 癌症相关的卡希克西亚和潜在治疗策略中的异常脂质代谢 表观遗传改变的巨噬细胞促进了与糖尿病相关的动脉粥样硬化的发展 一种量子知情方法进行健康传播研究的案例
化学性侵犯转移性结直肠癌(MCRC)的患者预后不佳。使用程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡配体1(PD-L1)抑制剂的应用鼓励改善MCRC微卫星不稳定性高(MSI-H)/不匹配修复维修剂(DMMR)的生存。不幸的是,对于MCRC而言,微卫星稳定(MSS)/优先不匹配修复(PMMR)无效,占MCRC的95%。放射疗法可以通过直接杀死肿瘤细胞并诱导阳性免疫活性来促进局部控制,这可能有助于协同进行免疫疗法。我们介绍了一名先进的MSS/PMMR MCRC患者,该患者在第一线化学疗法,姑息手术和二线化学疗法结合靶向疗法后患有进行性疾病(PD)。然后,患者接受了PD-1抑制剂的疗法,结合了放射疗法和粒细胞 - 巨噬细胞刺激因子(GM-CSF)。根据实体瘤版本1.1(recist1.1)的反应评估标准,该患者在三年后与无进展生存期(PFS)的三重疗法后显示了完全反应(CR),迄今为止已有2年以上的时间。患者除疲劳(1级)外没有其他明显的不良反应。三合一疗法为转移性化学难治性MSS/PMMR MCRC患者提供了有希望的策略。
利用辅助诱导的表观遗传调节,以增强疫苗和癌症治疗的免疫力
佐剂在疫苗和癌症疗法中至关重要,通过各种机制增强了治疗效率。在疫苗中,佐剂传统上是值得放大免疫反应的价值,从而确保了对病原体的强大和持久的保护。在癌症治疗中,佐剂可以通过靶向肿瘤抗原来提高化学疗法或免疫疗法的有效性,从而使癌细胞更容易受到治疗。最近的研究发现了佐剂的新分子水平效应,主要是通过表观遗传机制。表观遗传学包括基因表达中的可遗传修饰,这些修饰不会改变DNA序列,影响诸如DNA甲基化,组蛋白修饰和非编码RNA表达等过程。这些表观遗传变化在调节基因活性,影响免疫途径以及调节免疫反应的强度和持续时间方面起着关键作用。在疫苗或癌症治疗中,了解佐剂与表观遗传调节剂的相互作用如何为在各种医疗领域开发更精确的细胞靶向疗法提供显着潜力。本综述深入研究了佐剂的不断发展的作用及其与表观遗传机制的相互作用。还研究了利用表观遗传变化以增强辅助效率的潜力,并探讨了在治疗环境中表观遗传抑制剂作为辅助剂的新颖使用。
社论:高等植物应对非生物胁迫的遗传和表观遗传调控机制
遗传和表观遗传调控生物标记在植物抗逆分子机制和作物育种方法中起着至关重要的作用。由于不利的生长条件阻碍了作物产量和全球粮食安全,养活不断增长的全球人口是一项艰巨的任务。为了很好地解开上述机制,科学家们不得不整合多个植物研究领域,因此,他们必须具备丰富的生物信息学知识和工具来管理大数据集。从本质上讲,本主题中包含的常规文章涉及农民和股东面临的现代问题。为了解决这些问题,科学家们采用了多方面的研究方法,涵盖植物生理学、分子生物学、遗传学、表观遗传学和组学等各个领域,以及最先进的植物科学和尖端方法,这些方法由复杂的技术和先进的方法提供支持,包括全基因组关联研究 (GWAS) 和表观遗传学方法,以揭示植物对高温、盐分、干旱和病原体侵袭等胁迫(生物和非生物)的耐受机制。因此,可以将进化的分子技术投入到未来的作物育种策略中,以提高生产力并产生更能抵御环境挑战和抵抗病原体侵袭的新品种。值得注意的是,Kumar 等人通过两种不同的方法揭示了遗传可塑性的分子基础对水稻种植中不同环境条件的关键重要性。本专题汇集了新发现和有用方法来促进植物科学研究。它阐明了表观遗传学变化(例如 DNA 甲基化、组蛋白(去)乙酰化和其他翻译后修饰 (PTM))在基因调控(抑制或诱导)中的作用,以及组学(基因组学、表观基因组学、转录组学、代谢组学、离子组学和蛋白质组学)在检测应激反应基因中的作用。使用
乳腺癌抗肿瘤免疫和免疫治疗反应的表观遗传调节:生物学机制和临床意义
乳腺癌 (BC) 是最常见的非皮肤癌,也是美国女性癌症死亡的第二大原因。乳腺癌的发生和发展可以通过遗传和表观遗传变化的积累来进行,这些变化使转化细胞能够逃脱正常的细胞周期检查点控制。与核苷酸突变不同,DNA 甲基化、组蛋白翻译后修饰 (PTM)、核小体重塑和非编码 RNA 等表观遗传变化通常是可逆的,因此可能对药物干预有反应。表观遗传失调是抗肿瘤免疫力受损、免疫监视逃避和免疫疗法耐药的关键机制。与黑色素瘤或肺癌等高度免疫原性的肿瘤类型相比,乳腺癌被视为免疫静止肿瘤,其肿瘤浸润淋巴细胞 (TIL) 数量相对较少、肿瘤突变负荷 (TMB) 较低,对免疫检查点抑制剂 (ICI) 的反应率适中。新兴证据表明,针对异常表观遗传修饰因子的药物可能通过几种相互关联的机制增强 BC 中的宿主抗肿瘤免疫力,例如增强肿瘤抗原呈递、激活细胞毒性 T 细胞、抑制免疫抑制细胞、增强对 ICI 的反应以及诱导免疫原性细胞死亡 (ICD)。这些发现为使用表观遗传药物与免疫疗法的组合方法作为改善 BC 患者预后的创新范例奠定了非常有希望的基础。在这篇综述中,我们总结了目前对表观遗传修饰因子如何发挥作用的理解
社论:卵巢老化的遗传学和表观遗传学
生殖衰老始于女性的30多岁,更年期通常发生在48至50岁之间,而卵母细胞库存(卵巢衰老)的耗尽是女性一生中不可避免的过程,最终会影响预期和健康的影响。卵巢老化是一个多维过程,其特征是卵泡数量和卵母细胞质量的逐渐下降,大约37岁左右,导致后代的不育和先天性残疾增加(1)。尽管重要性很重要,但对人类卵巢衰老的基本生物学机制知之甚少,尤其是在延长女性生育能力和改善人口质量方面。尽管预期人类的预期寿命在过去一个世纪中显着延长,但绝经年龄在很大程度上保持不变,这暗示了遗传和表观遗传因素的潜在作用,但典范标志着启动的启动偏离衰老的启动,而在47%的案例中,遗传的年龄是遗传的,而不是遗传的年龄。口服避孕药,饮酒,吸烟和体育锻炼水平(3,4)调节这种内分泌老化过渡。最近,下丘脑 - 垂体轴的衰老以及端粒酶活性降低已成为生殖衰老的关键催化剂(5)。卵泡闭锁是由于颗粒和卵母细胞的细胞凋亡引起的,这是由活性氧(ROS)产生过多引起的,也会导致卵巢衰老。Wang L.等。 inWang L.等。in最近的研究使遗传多态性确定为自然更年期年龄异质性的主要贡献者,尤其是对于参与DNA修复途径的基因。病理卵巢衰老,例如早产卵巢不足和早期,也表现出相似的遗传敏感性(6)。这一现象的核心是卵巢功能的卵泡发育和维持,尤其是DNA甲基化的表观遗传修饰,在卵巢发育的关键阶段对基因表达产生了显着影响。这些研究提供了阐明遗传学与环境对卵巢衰老的相互作用的影响。该研究主题重点介绍了描述生理和病理卵巢衰老的遗传和表观遗传机制方面所取得的一些进步,从而提供了对延长女性生殖寿命的潜在机制的见解。研究表明DNA甲基化(DNAM)衰老与生殖衰老之间的联系。但是,DNAM与更年期年龄之间的因果关系仍然不确定。技术进步使使用各种分子或表型生物标志物测量生物年龄成为可能。
肝肿瘤对免疫疗法的抗性表观遗传机制
Note : Ion currents ( y i ) measured at the i th m/z that exhibit spectral interference are y 15 (i.e., CH 4 , C 3 H 8 , i -C 4 H 10 , and n -C 4 H 10 ), y 30 (i.e., C 2 H 6 , C 3 H 8 , and i -C 4 H 10 ), y 39 (i.e., C 3 H 6 , C 3 H 8 , i -C 4 H 10 , n -C 4 H 10 ,和C 5 H 12),Y 57(即I -C 4 H 10,N -C 4 H 10和C 5 H 12)和Y 58(即I -C 4 H 10和N -C 4 H 10)。粗体可易读。绿色代表主要质量,橙色代表相关的干扰。缩写:IC,离子电流。
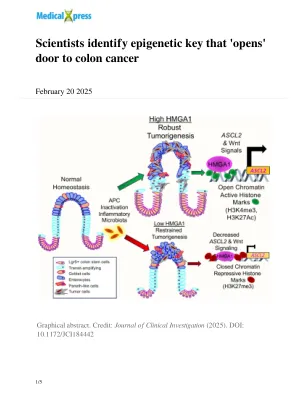
科学家确定了“打开”结肠癌门的表观遗传键
先前的研究发现,在结肠癌患者的肿瘤中,HMGA1基因表达高水平,但科学家不知道HMGA1在这种情况下可能扮演什么角色。Linda Resar,医学博士,Johns Hopkins Kimmel癌症中心的医学,病理学和肿瘤学教授,她的同事们表明,HMGA1有助于开启在腺瘤polyposis Coli(Mouse APC)基因中携带突变的小鼠中促进肿瘤基因的网络。APC基因是Kimmel Cancer Center研究人员在1991年发现的,APC的突变发生在所有结直肠肿瘤的90%以上。
SMARCB1缺陷肉瘤中PGBD5依赖性DNA损伤的表观遗传靶向
*通信:Alex Kentsis,医学博士,博士,电子邮件kentsisresearchgroup@gmail.com,电话25 +1-646-88888888888888888888-2593,纽约ZRC-1863,纽约,纽约,纽约,10021 26