XiaoMi-AI文件搜索系统
World File Search System2023 年人工智能行政命令的要点...
1.国务院;2.财政部;3.国防部;4.司法部;5.农业部;6.商务部;7.劳工部;8.卫生与公众服务部;9.住房和城市发展部;10.交通部;11.能源部;12.教育部;13.退伍军人事务部;14.国土安全部; 15.小型企业管理局;16.美国国际开发署;17.国家情报总监办公室;18.国家科学基金会;19.管理和预算办公室;20.科学技术政策办公室;以及 21.国家安全顾问;22.经济顾问委员会主任;23.国内政策顾问;24.副总统办公厅主任;25.性别政策委员会主任;26.经济顾问委员会主席;27.国家网络总监;和
微生物学的要点MBIO 1220-教学大纲ECE 2400 - 工程算法1什么是the-big-idea-transcript-dr-azad。 ...
开始分析来自加拿大家庭的数千种母乳样本。在这种情况下,我们对加拿大这里更普遍的食物过敏,肥胖和问题等事物更感兴趣。但是,当然,母乳也与世界其他地方普遍存在的其他疾病有关。因此,盖茨基金会资助的研究是在他们正在进行的其他一些研究上都可以背负。所以一个在坦桑尼亚,一个在布基纳法索,另一个在巴基斯坦。因此,我们能够与这些研究联系,让它们收集母乳样本,然后将其送到曼尼托巴省。,然后我的团队与世界各地的专家建立了联系。,因此我们将这支大型团队聚集在一起,然后将所有这些数据放在一起,并尝试了解它如何合作?它如何支持婴儿健康?
特朗普拒绝了拜登的AI行政命令,并进行了AI基础设施:雇主的关键要点
在特朗普总统新政府的最初几天,白宫对AI政策进行了彻底的转变:周一撤销了拜登总统在人工智能上的行政命令,并在周二宣布了由私营部门主导的AI基础设施投资。这一举动表明,与先前的政府的监管方法急剧不同,取代了AI监督,重点是经济增长和国家竞争力。雇主和人工智能行业领导者现在必须处理不断发展的景观,在该景观中,AI监管被放松,对AI开发的投资正在飙升。雇主的关键要点是什么?[ed。注意:发表洞察力后不久,特朗普在AI上发布了自己的行政命令 - 请参阅下文以获取快速描述。]
在炎症性风湿病中经济高效地使用生物和靶向合成 DMARD 需要考虑的要点:综合评估的结果
摘要 目的 制定基于证据的考虑要点,以便在治疗炎性风湿病(特别是类风湿性关节炎、银屑病关节炎和中轴型脊柱关节炎)时经济有效地使用生物和靶向合成的抗风湿药物 (b/tsDMARDs)。 方法 按照 EULAR 程序,成立了一个国际工作组,由来自七个欧洲国家的 13 位风湿病学、流行病学和药理学专家组成。通过个人和小组讨论,确定了 12 种经济有效使用 b/tsDMARD 的策略。对于每种策略,都在 PubMed 和 Embase 上系统地搜索相关的英文系统评价,对于六种策略,另外还搜索随机对照试验 (RCT)。纳入了 30 项系统评价和 21 项 RCT。根据证据,工作组使用德尔菲程序制定了一套总体原则和考虑要点。确定了每个要考虑的要点的证据等级(1a–5)和等级(A–D)。以匿名方式对同意等级(LoA;0(完全不同意)至 10(完全同意)之间)进行个人投票。结果工作组就五项总体原则达成一致。对于 12 种策略中的 10 种,证据足以形成一个或多个要考虑的要点,总共达到 20 个,涉及反应预测、药物处方集使用、生物仿制药、负荷剂量、低剂量初始治疗、同时使用常规合成 DMARD、给药途径、药物依从性、疾病活动指导的剂量优化和非医疗药物转换。10 个要考虑的要点(50%)得到了 1 级或 2 级证据的支持。平均 LoA(SD)在 7.9(1.2)和 9.8(0.4)之间变化。结论 这些需要考虑的要点可用于风湿病学实践,并补充炎症性风湿病治疗指南,以纳入 b/tsDMARD 治疗的成本效益。
肠道细菌最新研究的关键要点
在 Anne Nilsson、Olena Prykhodko 和 Hållenius 等人的研究中,参与者被要求将一个晚上的三明治中的白面包换成黑麦面包。第二天早上,他们的肠道菌群迅速改善,Faecalibacterium prausnitzii 细菌的含量增加,这种细菌已被证明具有抗炎作用。黑麦面包还增加了肠道中 Prevotella 的数量,这是一种对血糖调节有良好作用的细菌。
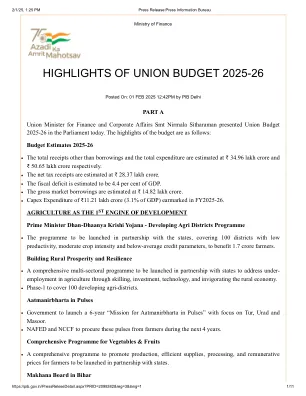
2025-26 年联邦预算要点 - 新闻信息局
纺织品:另外两种无梭织机完全免征纺织机械税。针织物的 BCD 税率从“10% 或 20%”修改为“20% 或每公斤 115 卢比,以较高者为准”。电子产品:交互式平板显示器(IFPD)的 BCD 从 10% 增加到 20%。开式电池和其他组件的 BCD 降至 5%。开式电池零部件的 BCD 豁免。锂离子电池:电动汽车电池制造的额外 35 种资本货物和手机电池制造的额外 28 种资本货物豁免。航运业:船舶制造所用的原材料、部件、消耗品或零件的 BCD 豁免再延长十年。拆船继续适用同样的豁免。电信:电信级以太网交换机的 BCD 从 20% 降低到 10%。
教育转型计划讨论要点 - Google Docs
最后,我们赞赏州长今年为缓解资金压力所做的努力,为探索教育资金的系统性变革提供了空间。普通基金预算的许多部分都会影响学校的日常运营。如果将普通基金中的资金转移到减少财产税上,从而不得不削减其他关键项目,尤其是心理健康服务,那么这样做是适得其反的,因为这最终会增加学校日常需要解决的需求。
FDA 更新确认性试验指南的要点
1 月 6 日,美国食品药品管理局发布了一份关于加速审批以及确定是否正在进行确认性试验的考虑因素的指南草案。[1] 该指南草案回应了 FDA 根据 2023 年综合拨款法案管理加速审批计划的新权力和职责,FDA 在初始指南草案中对此进行了高层讨论。[2] 新的指南草案缩小了对确认性试验的严格要求,并概述了确保进行确认性试验以验证加速审批药物临床益处的具体流程。 FDA 正在邀请公众对该指南草案发表意见,截止日期为 3 月 10 日。背景加速批准计划在治疗某些严重或罕见疾病的迫切需要和同样重要的确保患者安全的需要之间取得了平衡,即在传统的三期临床研究路线下,在确定合理可能预测药物最终临床益处的替代终点或中间终点的基础上,允许在药物被有条件地批准用于治疗严重或罕见疾病之前,对药物进行有条件批准。[3] 作为加速批准的一项条件,申办方必须进行上市后确认试验,以验证预期的临床益处,即支持符合 FDA 全面上市批准标准的完整安全性和有效性发现。因此,成功完成这些确认研究会将药物的加速批准转为传统批准。新的确认试验要求在本指南草案中,FDA 详细解释了上个月指南草案中建立的更高要求,即在加速批准之前必须进行确认试验。根据这项加强的要求,FDA 规定,在加速批准之前,确认性试验“即使没有全部招募,也必须进行得非常顺利”,在批准后招募特别困难的情况下,必须全部招募。该机构解释说,如果试验 (1) 的目标完成日期“与认真及时地进行试验相一致;(2) “申办方的进展和批准后试验的计划足以保证试验按时完成”;(3) 试验的招募至少已经开始,则该试验正在进行中。
SGLT2 抑制剂使用的实用要点
可增加地高辛的血浆最大血浆浓度(Cmax:36%)和曲线下面积(AUC:20%)。建议在同时使用时进行治疗药物监测,并根据需要调整地高辛的剂量。