XiaoMi-AI文件搜索系统
World File Search SystemLANGUAGE IIv3 DCC 解码器编程器用户指南
SPROG II 是一个 DCC 解码器编程器,用于连接到个人计算机或类似设备的 USB 端口。SPROG II 由 DecoderPro 和 PanelPro 支持,两者都是 JMRI 项目 ( http://jmri.sourceforge.net/ ) 的一部分,通过使用 Java 编程语言,允许独立于平台支持各种 DCC 硬件。JMRI 软件是可免费下载的共享软件。
LANGUAGE IIv3 DCC 解码器编程器用户指南
SPROG II 是一个 DCC 解码器编程器,用于连接到个人计算机或类似设备的 USB 端口。SPROG II 由 DecoderPro 和 PanelPro 支持,两者都是 JMRI 项目 ( http://jmri.sourceforge.net/ ) 的一部分,通过使用 Java 编程语言,允许独立于平台支持各种 DCC 硬件。JMRI 软件是可免费下载的共享软件。
基于极地代码的查找表的展开和管道解码器
摘要 - 解码算法允许以增加面积的成本实现极高的吞吐量。查找表(LUTS)可用于替换其他作为电路实现的功能。在这项工作中,我们显示了通过在独立的解码器中精心制作的LUTS代替逻辑块的影响。我们表明,使用LUTS改善关键性能指标(例如,区域,吞吐量,潜伏期)可能比预期更具挑战性。我们提出了三种基于LUT的解码器的变体,并详细描述了它们的内部工作以及电路。基于LUT的解码器与常规展开的解码器进行了比较,该解码器采用固定点表示数字,具有可比的误差校正性能。简短的系统极性代码被用作说明。所有由此产生的展开解码器均显示能够在28 nm FD-SOI技术中以1.4 GHz至1.5 GHz的时钟进行少于10 Gbps的信息吞吐量。与常规展开的解码器相比,我们的基于LUT的解码器的最佳变体可将面积的需求降低23%,同时保留可比的错误校正性能。
自主驾驶中场景流网络的解码器
摘要 - 场景流估计通过预测场景中的点运动来确定场景的3D运动场,尤其是在自主驾驶中的帮助任务时。许多具有大规模点云的网络作为输入使用Voxelization来创建用于实时运行的伪图像。但是,体素化过程通常会导致特定点特征的丧失。这引起了为场景流任务恢复这些功能的挑战。我们的论文引入了Deflow,该文件可以从基于体素的特征过渡到使用门控复发单元(GRU)改进的点特征。为了进一步增强场景流量估计的性能,我们制定了一种新颖的损失函数,以解释静态点和动态点之间的数据不平衡。对Argoverse 2场景流量任务的评估表明,Deflow在大规模点云数据上取得了最新的结果,表明我们的网络与其他网络相比具有更好的性能和效率。该代码在https://github.com/kth-rpl/deflow上进行开源。
具有二进制解码器功能的生物混合材料电路的设计
合成生物学应用了电气工程和信息处理的概念,赋予细胞计算功能。将底层分子成分转移到材料中,并根据受电子电路板启发的拓扑结构进行连接,已经产生了执行选定计算操作的材料系统。然而,现有构建块的有限功能限制了将高级信息处理电路实现到材料中。在这里,设计了一组基于蛋白酶的生物混合模块,其生物活性可以被诱导或抑制。在定量数学模型的指导下,遵循设计-构建-测试-学习 (DBTL) 循环,模块根据受电子信号解码器启发的电路拓扑进行连接,这是信息处理的基本主题。设计了一个 2 输入/4 输出二进制解码器,用于检测材料框架中的两个小分子,这些小分子可以以不同的蛋白酶活性形式执行受调节的输出。这里展示的智能材料系统具有很强的模块化,可用于生物分子信息处理,例如在高级生物传感或药物输送应用中。
自动形态合奏的极性代码解码器6G URLLC
根据作者克劳斯·凯斯特尔(Claus Kestel),马文·盖塞尔哈特(Marvin Geiselhart),卢卡斯·约翰逊(Lucas Johannsen),斯蒂芬·恩·布林克(Stephan Ten Brink)和诺伯特·韦恩(Norbert Wehn)的作者克劳斯·凯斯特尔(Claus Kestel)和诺伯特·韦恩(Norbert Wehn),的题为“ 6G urllc的自动化集合代码解码器”,这是即将到来的6G标准标准的urllc sereario。 实现接近ML的性能是具有挑战性的,尤其是对于短块长度。 极性代码是此应用程序的有前途的候选人。 上述论文讨论了连续的取消列表(SCL)解码算法,该算法提供了良好的误差校正性能,但在高计算解码的复杂性下。 本文引入了自动形态集合解码(AED)方法,该方法在并行执行了几种低复杂性解码。 本文介绍了AED架构,并将其与最先进的SCL解码器进行了比较。 因此,鉴于Kestel等人的理论和实验证明,我们在这里概述了由TLB GmbH管理的PCT应用保护的这项技术发明的位置和背景。的题为“ 6G urllc的自动化集合代码解码器”,这是即将到来的6G标准标准的urllc sereario。实现接近ML的性能是具有挑战性的,尤其是对于短块长度。极性代码是此应用程序的有前途的候选人。上述论文讨论了连续的取消列表(SCL)解码算法,该算法提供了良好的误差校正性能,但在高计算解码的复杂性下。本文引入了自动形态集合解码(AED)方法,该方法在并行执行了几种低复杂性解码。本文介绍了AED架构,并将其与最先进的SCL解码器进行了比较。因此,鉴于Kestel等人的理论和实验证明,我们在这里概述了由TLB GmbH管理的PCT应用保护的这项技术发明的位置和背景。
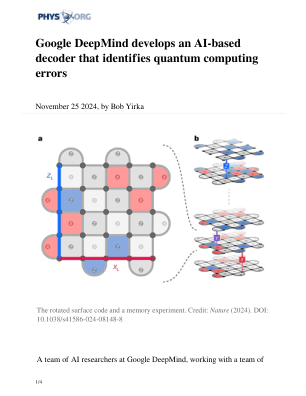
Google DeepMind 开发基于 AI 的解码器,可识别量子计算错误
过去几年,谷歌人工智能部门一直在开发和研究一款名为 Sycamore 的量子计算机。为了进行量子计算,它使用多个硬件量子位创建单个逻辑量子位,这些量子位用于运行程序,同时执行错误校正。在这项新工作中,该团队开发了一种查找和纠正此类错误的新方法,并将其命名为 AlphaQubit
Pocket2Drug:基于目标的药物设计的编码器-解码器深度神经网络
计算建模是现代药物发现的重要组成部分。其最重要的应用之一是选择有希望的药理学相关靶蛋白候选药物。由于结构生物学的不断进步,在与各种疾病相关的众多蛋白质中发现了小有机分子的假定结合位点。这些宝贵的数据为通过应用数据挖掘和机器学习来构建预测靶位结合分子的有效计算模型提供了新的机会。特别是,深度神经网络是一种强大的技术,能够从复杂数据中学习,从而做出明智的药物结合预测。在本文中,我们描述了 Pocket2Drug,这是一种深度图神经网络模型,用于预测给定配体结合位点的结合分子。这种方法首先从大量口袋结构数据集中通过监督训练学习小分子的条件概率分布,然后从训练模型中抽样候选药物。全面的基准模拟表明,与传统的药物选择程序相比,使用 Pocket2Drug 显著提高了找到与靶口袋结合的分子的机会。具体来说,已知结合物针对测试集中存在的多达 80.5% 的靶标生成,而测试集由与用于训练深度图神经网络模型的数据不同的数据组成。总体而言,Pocket2Drug 是一种很有前途的计算方法,可用于指导新型生物制药的发现。
基于强化学习的皮层内脑机接口快速自校准解码器
摘要:背景:由于皮层内脑机接口中神经记录的非平稳性,需要每天以监督的方式进行再训练以保持解码器的性能。使用基于强化学习(RL)的自校准解码器可以改善此问题。然而,在保持良好性能的同时快速探索新知识仍然是基于RL的解码器的挑战。方法:为了解决这个问题,我们提出了一种基于注意力门控RL的算法,该算法结合了迁移学习、小批量和权重更新方案来加速权重更新并避免过度拟合。所提出的算法在两只猴子的皮层内神经数据上进行了测试,以解码它们的伸手位置和抓握姿势。结果:解码结果表明,与未再训练的分类器相比,我们提出的算法的分类准确率提高了约20%,甚至比每日再训练的分类器取得了更好的分类准确率。此外,与传统的RL方法相比,我们的算法将准确率提高了约10%,在线权重更新速度提高了约70倍。结论:本文提出了一种自校准解码器,该解码器具有良好且稳健的解码性能,权重更新速度快,可能有助于其在可穿戴设备和临床实践中的应用。
ADV7181 多格式 SDTV 视频解码器数据手册 (Rev. B)
特性 多格式视频解码器支持 NTSC-(J、M、4.43)、PAL-(B/D/G/H/I/M/N)、SECAM 集成三个 54 MHz、9 位 ADC 由单个 27 MHz 晶振计时 线路锁定时钟兼容 (LLC) 自适应数字线路长度跟踪 (ADLLT™) 5 线自适应梳状滤波器 专有架构,用于锁定弱、嘈杂和不稳定的视频源,如 VCR 和调谐器 副载波频率锁定和状态信息输出 集成 AGC 和自适应峰值白模式 Macrovision® 版权保护检测 CTI(色度瞬态改善) DNR(数字降噪) 多种可编程模拟输入格式: CVBS(复合视频) S-Video (Y/C) YPrPb 分量(VESA、MII、SMPTE 和 Betacam) 6 个模拟视频输入通道 自动 NTSC/PAL/SECAM 识别 数字输出格式(8 位或 16 位): ITU-R BT.656 YCrCb 4:2:2 输出 + HS、VS 和 FIELD 0.5 V 至 1.6 V 模拟信号输入范围差分增益:0.6% 典型值