XiaoMi-AI文件搜索系统
World File Search System药物毒性和反应的药物基因组学检测
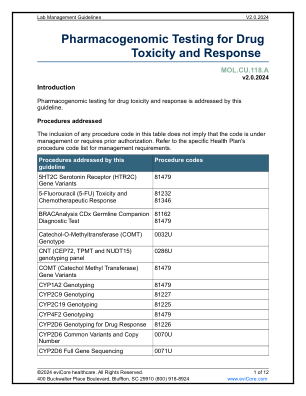
伴随诊断是帮助确定某种药物对特定个体是否安全或有效的检测方法。伴随检测是美国食品药品管理局 (FDA) 新药开发和审批流程的一部分。FDA 表示,“伴随诊断是一种医疗器械,通常是体外器械,它提供对相应药物或生物制品的安全有效使用至关重要的信息。该检测可帮助医疗保健专业人员确定某种治疗产品对患者的益处是否大于任何潜在的严重副作用或风险。”1 虽然 FDA 标签上可能会注明特定的伴随诊断检测以批准新药,但由 CLIA 认证实验室执行的类似实验室开发检测 (LDT) 普遍被接受为可提供所需信息的替代方案。
FDA 的个性化医疗
3. 批准或批准 12 种诊断检测系统的重要新适应症或扩大适应症,这些系统可以帮助将治疗定向提供给那些将受益的人,从而为那些不会受益的人节省费用和副作用。新批准的适应症包括三种新的基于血液的生物标志物检测,用于指导个性化肿瘤治疗决策。这些检测将拓展微创液体活检的领域,对于某些癌症患者来说,这可以替代组织活检。几项新批准的适应症还将推进肿瘤无关检测范式,该范式有望将个性化医疗的好处扩展到更多的癌症患者,方法是将个性化医疗定向提供给所有肿瘤表达某些生物标志物的患者,无论这些肿瘤位于身体的哪个部位。
耐药性结核病中的贝达喹啉耐药性
荟萃分析还确定了 141 个耐药相关变异 (RAV),包括 58 个独特位点上的 71 个独特 RAV。四个 RAV 被定位到结核分枝杆菌基因组的启动子区域,19 个被定位到二聚化域,42 个被定位到 DNA 结合区域。基因型耐药标记和表型耐药之间的一致性较差被强调为开发贝达喹啉耐药性快速分子诊断检测的主要制约因素。总之,这项工作要求加强对贝达喹啉耐药性的监测,加大对快速表型检测的投资和创新,并加强国家结核病规划,以消除与结核病相关的灾难性成本,提高治疗依从性,并保持高水平的护理保留率。
2025 年 1 月 4 日
印度教徒报 –GS2(健康)-第 1 页 • 印度卫生部周五表示,正在密切监测中国据称爆发的人类偏肺病毒 (HMPV) 疫情。卫生部表示,虽然中国报告呼吸道疾病(尤其是 HMPV)有所增加,但印度并未发现冬季呼吸道疾病出现任何异常激增。 • 新冠疫情爆发五年后,中国 HMPV 病例激增,尤其是 14 岁以下儿童。症状包括咳嗽、发烧和呼吸急促,并可能出现支气管炎和肺炎等并发症。 • HMPV 于 2001 年发现,与呼吸道合胞病毒 (RSV) 同属于肺病毒科。分子诊断检测的广泛使用提高了对 HMPV 作为上呼吸道和下呼吸道感染重要原因的识别和认识。
确保 qPCR 数据的可靠性——控制污染
表 1。*使用对照模板材料进行验证提供了有关检测效率和检测限的更多信息。Bustin 等人2 描述了一项开发临床诊断检测的示范性研究。他们开发了一种多重 qRT-PCR,用于从临床样本中检测 SARS-CoV-2,并在应用于患者材料时包括开发和纳入质量控制评估的对照。阴性对照是一个简单的“无模板对照”,包含除模板以外的所有检测成分。这是在验证检测和多重组合时运行的。检测描述清楚地表明,在没有模板的情况下,无论是单次检测还是多重检测,都不会扩增任何产品。这证实了所有检测的引物均未发生相互作用,并且特定模板未进入反应成分。
使用核酸探针鉴定微生物 AHS – M2097
核酸杂交技术利用 DNA 双螺旋结构的互补特性将来自不同来源的 DNA 片段退火在一起。这些技术用于聚合酶链式反应 (PCR) 和荧光共振能量转移 (FRET) 技术来识别微生物 (Khan, 2014)。对可能用探针技术检测到的每种传染性病原体的讨论超出了本政策的范围。许多探针已组合成测试组。出于本政策的目的,仅审查单个探针。有关阴道炎念珠菌核酸鉴定的指导,请参阅 AHS-M2057- 阴道炎诊断,包括多目标 PCR 检测。相关政策 肝炎检测 AHS – G2036 莱姆病 AHS – G2143 病原体检测 AHS – G2149 常见性传播感染诊断检测 AHS – G2157 媒介传播感染检测 AHS – G2158 阴道炎诊断 AHS – M2057
派姆单抗:胡桃夹子 - Thieme Connect
摘要 抗程序性细胞死亡-1 (PD-1)/PD 配体-1 免疫检查点抑制剂 (ICI) 是获批用于治疗各种晚期癌症的最新一类药物。抗 PD1 抑制剂 Pembrolizumab 被批准用于治疗晚期实体恶性肿瘤和难治性淋巴瘤。最近,它已被批准作为微卫星不稳定性高晚期疾病的肿瘤不可知疗法。在所有这些研究中,pembrolizumab 均显示出显著的疗效,且 3/4 级免疫相关不良事件较少。同时,免疫疗法为诊断检测和免疫疗法相关反应评估标准定义铺平了道路。除个别病例报告外,尚无印度使用 ICI 的经验发表。本文旨在回顾 pembrolizumab 的机制、适应症和安全性。其他 ICI 的描述超出了本综述的范围。
PE2086/E:识别疫苗损伤者并提供适当的治疗
在接种疫苗之前,我们要求接种者了解副作用并获得知情同意。在疫情期间,我们向 COVID-19 疫苗接种者提供了尽可能多的有关潜在副作用的信息,并且将继续提供这些信息。每封预约信中都附有传单,提供有关潜在副作用的信息。这些信息与 NHS Inform 和药品和保健产品管理局 (MHRA) 提供的进一步详细信息有明确的链接。患者在预约时会收到更多副作用材料,包括我们的 NHS 副作用传单和个别制造商的“患者信息传单”。这些为患者提供了详细说明可能的风险和副作用的清晰信息,以便他们做出是否希望接种疫苗的明智决定。患者信息传单也可以在 NHS Inform 上找到。如果患者有任何其他疑问,诊所的工作人员都接受过回答有关副作用的任何问题的培训,并且每位患者在接种疫苗之前都必须给予知情同意。如请愿人在其提交的材料中所述,如有需要,可提供专科诊断检测和专科治疗。应根据每位患者的症状进行单独评估,并提供最合适的治疗。目前尚无针对 COVID-19 疫苗相关危害的专科诊断检测,但可以通过其他方式诊断患者。正如我们在对原始请愿的回复中所述,临床医生通常无法确定患者症状或疾病的原因。诊断的一个例子是患者是否出现特定病症。可以对他们进行测试以确认他们是否患有该病症,并且该病症可能是 COVID-19 疫苗的已知副作用。可以进行进一步的测试或临床评估以排除其他可能的原因,例如 COVID-19 感染或其他感染,但最终可能没有任何明确的证据可以完全确认该病症是否由接种疫苗引起。无论个人如何感染该病症,他们都会得到与其他患者相同的治疗。医疗保健提供者意识到 Covid-19 疫苗可能产生的副作用,并在考虑治疗可能因接种疫苗而出现的症状时运用这些知识
美国全面实施新冠肺炎病例发现和接触者追踪的国家计划
为了在未来控制 COVID-19 疫情,美国各社区需要:(1) 为所有有症状的病例或有合理理由怀疑接触过 COVID-19 的病例提供快速诊断检测;(2) 进行广泛的血清学检测,以了解潜在的感染率,并确定哪些人已经产生免疫力,有可能重返工作岗位或学校而不必担心被感染;(3) 能够追踪已报告病例的所有接触者。为了追踪所有接触者、安全隔离病人并隔离接触者,我们估计我们的公共卫生工作人员需要增加大约 100,000 名(有偿或志愿)接触者追踪员来协助这项大规模工作。这支队伍可以战略性地部署到最需要的地区,并通过处于 COVID-19 响应前线的州和地方公共卫生机构进行管理。为此,我们还估计国会将需要向州和地区卫生部门拨款约 36 亿美元的紧急资金。
nOPV2 常见问题 (FAQ)
nOPV2 在 2020 年 11 月获得使用建议后,正在根据世卫组织的紧急使用清单 (EUL) 程序进行部署。EUL 是世卫组织的一项监管机制,它涉及对现有数据进行仔细和严格的分析,以便尽早有针对性地使用尚未获得许可的疫苗、诊断检测和治疗,以应对国际关注的突发公共卫生事件 (PHEIC)——自 2014 年以来,脊髓灰质炎就属于这一类别。EUL 用于确保快速提供多种疾病所急需的卫生产品。世卫组织免疫战略咨询专家组 (SAGE) 分别于 2019 年 10 月和 2021 年 10 月批准加快 nOPV2 的临床开发及其根据 EUL 的评估,并根据初始使用期的积极安全性结果过渡到疫苗的更广泛使用阶段。