XiaoMi-AI文件搜索系统
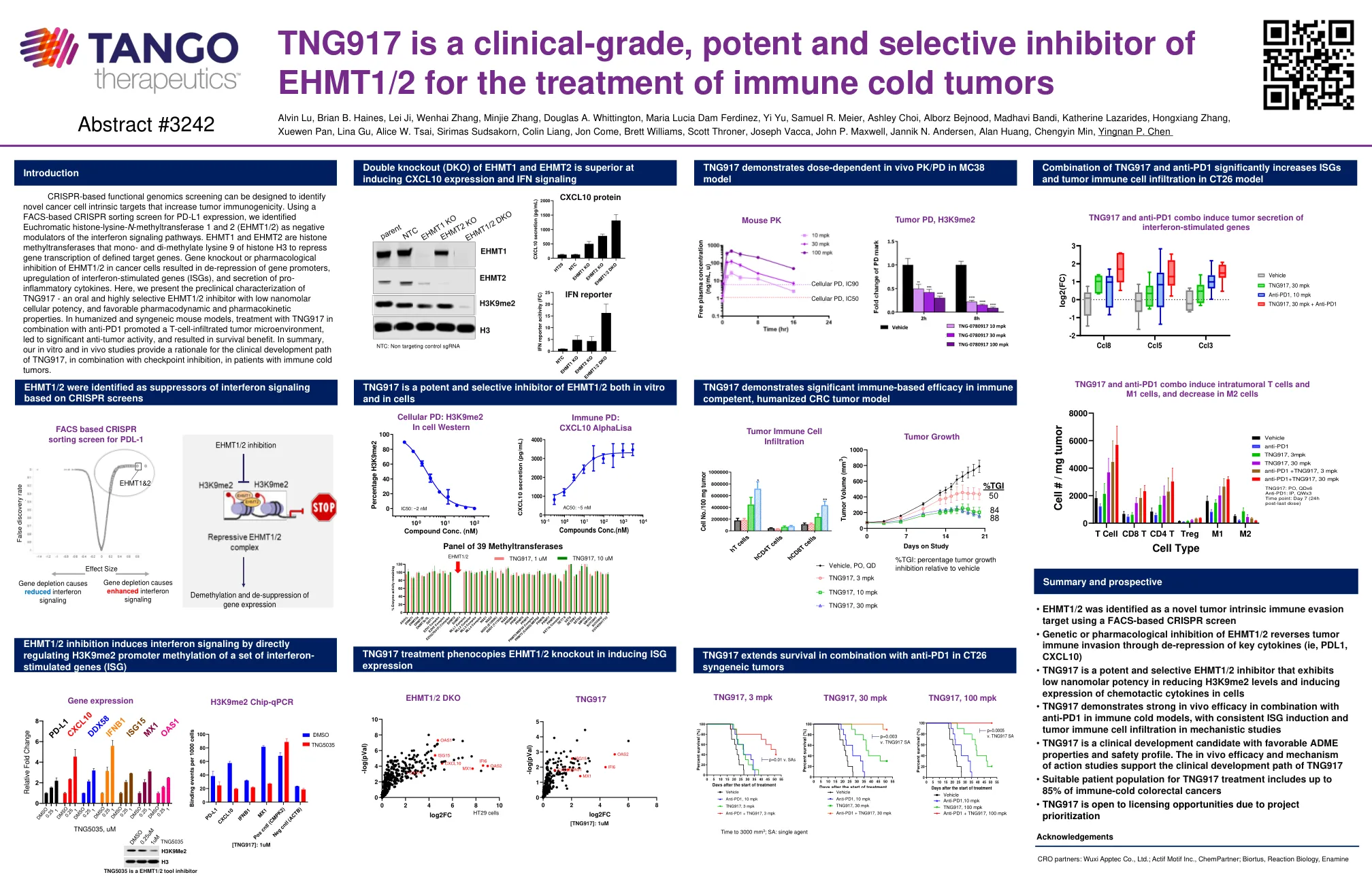
World File Search SystemTNG917是一种用于治疗免疫冷肿瘤的临床级,有效和选择性抑制剂
基于CRISPR的功能基因组学筛查可以设计用于鉴定增加肿瘤免疫原性的新型癌细胞固有靶标。使用基于FACS的CRISPR分类屏幕用于PD-L1表达,我们确定了正式的组蛋白 - 赖氨酸-N-甲基转移酶1和2(EHMT1/2)是干扰素信号通路的负调节剂。EHMT1和EHMT2是组蛋白H3的单甲基赖氨酸9的组蛋白甲基转移酶,以抑制定义靶基因的基因转录。基因敲除或对癌细胞中EHMT1/2的药理抑制作用导致基因启动子的抑制,干扰素刺激的基因(ISGS)的上调以及炎性细胞因子的分泌。在这里,我们介绍了TNG917的临床前表征 - 口服和高度选择性的EHMT1/2抑制剂,具有低纳摩尔细胞效力,以及有利的药效和药物性特性。在人性化和合成小鼠模型中,与抗PD1结合使用TNG917处理促进了T细胞浸润的肿瘤微环境,导致了显着的抗肿瘤活性,并带来了生存益处。总而言之,我们的体外和体内研究为免疫冷肿瘤患者的临床发展路径提供了临床发育路径的基本原理。
针对NSD2介导的SRC-3液体#8364
化学抗性的发展是多发性骨髓瘤(MM)临床管理失败的主要原因,但是相互作用以赋予这种化学抗性的遗传和表观遗传畸变仍然未知。在本研究中,我们发现高类固醇受体共激活剂3(SRC-3)表达与基于硼替佐米(BTZ)的MM患者的复发/难治性和不良结局相关。此外,在永生的细胞系中,高SRC-3增强了对蛋白酶体抑制剂(PI)诱导的凋亡的抗性。过表达的组蛋白甲基转移酶NSD2在具有T(4; 14)易位的患者中或在BTZ耐药的MM细胞中通过增强其液相 - 液相分离以超天然修饰的组蛋白H3赖氨酸36赖氨酸36二甲基化(H3K36MEE2)的模态,从而使SRC-3升高升高。使用新开发的抑制剂SI-2靶向SRC-3或其与NSD2的相互作用,使BTZ处理敏感并克服了体外和体内耐药性。总而言之,我们的发现阐明了MM获得的耐药性耐药性中先前未识别的SRC-3和NSD2编排,并表明SI-2可能会在MM患者中克服耐药性。
血小板传播-1介导Rho-激酶抑制剂...
图7细胞运动分析显示了TSP1抑制剂和siRNA敲低的作用。间隙打开区域的呈现为第0天间隙宽度的百分比。(a)以不同浓度的LSKL或SLLK处理(每组n = 3)。(b)用TSP1 siRNA和NC炒对照siRNA转染(每组n = 3)。(c)1 µM Y39983与5 µM LSKL或SLLK(每组n = 4)的处理。(d)1 µM Y39983的处理与100 pmol的对照或TSP1 siRNA(每组n = 4)。(E)在1 µM Y39983处理中与5 µM LSKL或SLLK的治疗中的Transwell迁移2天(每组n = 3)。(f)在1 µM Y39983与100 pmol的对照或TSP1 siRNA的处理中,Transwell迁移2天(每组n = 3)。sllk:控制肽; LSKL:TSP1阻断肽。数据表示平均值±SEM。lskl,亮氨酸 - 丝氨酸 - 赖氨酸 - 亮氨酸; NC,阴性对照; NS,没有统计学意义; siRNA,小干扰RNA; SLLK,丝氨酸 - 亮氨酸 - 亮氨酸 - 赖氨酸; TSP1,血小板传播-1。**p≤0.01; *p≤0.05(Student's T -Test)
沙门氏菌Shigella琼脂/XLD琼脂
1。预期的用途检测和分离革兰氏阴性肠病原体,尤其是人类临床标本和其他标本中的志贺氏菌和沙门氏菌。革兰氏阴性肠病原体(尤其是志贺氏菌和沙门氏菌)的Shalmella shigella琼脂/XLD琼脂。沙门氏菌琼脂/XLD琼脂的功能是支持症状患者的诊断,表明革兰氏阴性肠病原体,尤其是Shigella属和沙门氏菌的病原体潜在感染。沙门氏菌是食物中毒的一些最常见的病因。这些微生物的致病性从一种血清变化到另一种血清,并且在同一亚种中可能会有所不同。一些血清造成了侵入性疾病,但也有一些造成自限性食物中毒的血清疾病。沙门氏菌肠subsp的最孤立的血清。肠道是S. enteritidis,S。Typhimurium,S。Virchow,S。Hadar或S. iftantis。Shigella属包括四种:S。dysenteriae,s。Flexneri,S。Boydii和S. Sonnei。所有物种都是强制性的病原体,并引起细菌痢疾。2。手术沙门氏菌琼脂的原理胆汁盐,孔雀石绿色和柠檬酸钠的存在抑制了除沙门氏菌和志贺氏菌以外的革兰氏阳性微生物和肠杆菌的生长。由于添加乳糖,肠杆菌的分化是可能的。乳糖发酵细菌会产生酸并形成红色菌落,这是由于中性红色的pH指示剂。相反,乳糖非发酵微生物形成无色菌落。柠檬酸铁是硫化氢产生的指标。沙门氏菌产生硫代硫酸盐还原酶,该酶释放出存在于硫代硫酸钠中的硫化物分子。这些分子与氢离子结合,形成H 2 S,与柠檬酸铵反应。这种反应导致形成沉淀物,可见在细菌菌落中心的黑点。XLD琼脂酵母提取物是培养基中养分的来源。脱氧胆酸钠的存在抑制了革兰氏阳性细菌的生长。由于三个指示系统,细菌的分化是可能的: - 乳糖,木糖和蔗糖与苯酚红(这是pH指示剂) - - 盐酸l-赖氨酸盐和苯酚红色, - 硫代硫酸钠和柠檬酸铁硫酸盐。木糖的发酵降低了培养基的pH值,并使其从红色变为黄色。包括沙门氏菌在内的大多数肠道病原体能够发酵木糖,从而导致培养基的酸化。由于志贺氏菌的细菌是乳糖的非发酵,因此不会产生酸,因此会形成红色菌落。赖氨酸允许将沙门氏菌细菌与其他非致病细菌区分开。一旦木糖耗尽,沙门氏菌细菌在脱羧过程中利用L-赖氨酸,这将培养基的pH水平改变为碱。为防止赖氨酸阳性大肠菌群,乳糖和蔗糖的类似pH水平的类似回归,以产生多余的酸。氯化钠保持渗透平衡。柠檬酸铵是硫化氢生产的指标。沙门氏菌产生硫代硫酸盐还原酶,该酶释放出存在于硫代硫酸钠中的硫化物分子。这些分子与氢离子结合形成H 2 s,与柠檬酸铁反应形成沉淀物,可见在细菌菌落中的黑色中心。产生H 2 S的非致病细菌不脱羧L-赖氨酸。因此,它们产生的酸反应阻止了菌落的变化。
精神分裂症相关基因AS3MT的功能表征鉴定出在神经元发育中的作用。
图4在分化的AS3MT敲除和野生型细胞系之间未观察到形态差异:使用10μM视黄酸的细胞系在7天内使用10μM视黄酸和1%FBS在酸蚀刻,层粘连蛋白和多赖氨酸和多赖氨酸覆盖的覆盖物上覆盖,以获取MAP2,以获取MAP2,以获取cytoskeposkemeleckkeletalsmembeletalmarkeral。(a)敲除(KO)或野生型(wt)AS3MT线之间的MAP2 +单元总数没有差异(t检验,T [0.875] = 1.19,p = 0.523)b)kO和WT AS3MT线之间的细胞面积没有差异(T AS3MT test test,t test,T [1.98] [1.98] = 1.198],P。c)KO和WT AS3MT线之间的最长神经突长度没有差异(t检验,t [1.99] = 1.10,p = 0.386)。d)KO和WT AS3MT线之间的总神经突长度没有差异(t检验,t [1.11] = 0.937,p = 0.508)。在两个独立的KO/WT细胞系上进行了三个技术重复,进行了每个实验。条代表每个基因型的两个细胞系的平均值。错误是平均值±SEM
海藻酸盐-εPLL 核壳水凝胶珠可作为有效、稳定且可扩展的微生物包封工具
摘要:合成微生物联合体在生物技术应用方面具有巨大潜力。然而,由于竞争动态和物种间生长速度不平衡,实现稳定且可重复的共培养具有挑战性。本文,我们提出了一种有效的微生物包封方法,该方法基于涂有 ε-聚-L-赖氨酸 (εPLL-HB) 的海藻酸盐基核壳水凝胶珠。该方法可确保微生物完全封闭,同时允许特征差异很大的几种微生物在珠内持续生长。与壳聚糖和 α-聚-L-赖氨酸(两种最常用的此类包封包覆剂)相比,εPLL 在避免细胞在不同培养条件下和所有测试的微生物菌株逃逸方面表现出优异的性能,同时允许它们在胶囊内增殖。εPLL-HB 能够构建空间组织的共培养,有效地平衡不同生长速度的微生物之间的种群。此外,εPLL-HB 可防止木质纤维素衍生介质中的有毒化合物,并在 -80°C 长期储存后仍能保持其包封效果和活力。εPLL-HB 具有出色的微生物控制、结构完整性和耐化学性,再加上价格低廉和易于制备,使其成为设计合成微生物联合体的多功能工具,在生物技术过程中具有广泛的适用性。
与Ashwagandha,甜菜根
Energy 1,213 KJ (290kcal) Carbohydrates 23.9 gm Sugar 3.1 gm Dietary fibre 3.6 gm Fat 7.72 gm saturated 2.65 gm Monounsaturated 0.675 gm polyunsaturated 2.08 gm Protein 57.47 gm Tryptophan 0.929 gm Threonin 2.97 gm Isoleucine 3.025 gm leucine 4.947 gm赖氨酸3.025克蛋氨酸1.149gm Cystine 0.662gm苯丙氨酸2.777GM酪氨酸2.854gm valine 3.512 GM精氨酸4.147 gm
KDM1A 维持转录增强子的全基因组稳态
转录增强子能够对后生动物的基因表达进行精确的时空控制。组蛋白 H3 赖氨酸 4 (H3K4me1) 的单甲基化富集是转录增强子的主要染色质特征。赖氨酸 (K) 特异性脱甲基酶 1A (KDM1A,也称为 LSD1) 是一种 H3K4me2/me1 脱甲基酶,可在小鼠胚胎干细胞 (mESC) 分化过程中使干细胞增强子失活。然而,其在未分化 mESC 中的作用仍不清楚。在这里,我们表明 KDM1A 在未分化和谱系定向细胞中都积极维持最佳增强子状态。KDM1A 占据了未分化 mESC 中的大部分增强子。增强子处的 KDM1A 水平与其底物 H3K4me2、H3K27ac 和增强子处的转录呈现明显的正相关性。在缺乏 Kdm1a 的 mESC 中,这些增强子中的大部分获得了额外的 H3K4 甲基化,同时伴有 H3K27 乙酰化增加以及增强子 RNA (eRNA) 和靶基因表达增加。在有丝分裂后的神经元中,KDM1A 的缺失会导致神经元活动依赖性增强子和基因的过早激活。总之,这些结果表明 KDM1A 是一种多功能的增强子调节器,并充当变阻器,通过平衡增强子处的 H3K4 甲基化来维持最佳增强子活性。
评估尿液 6‐氧代‐哌可酸作为 ALDH7A1 缺乏症的生物标志物
ALDH7A1 缺乏症是一种常染色体隐性癫痫性脑病,通常在出生后几周至几个月内出现。这种疾病通常对一般抗惊厥药物治疗没有反应,但对吡哆醇(维生素 B 6 的一种形式)补充剂有反应。ALDH7A1 的致病变异编码赖氨酸分解代谢途径中的 α -氨基己二酸半醛 (α-AASA) 脱氢酶,导致 α-AASA 及其环状形式 Δ 1-哌啶-6-羧酸 (P6C) 积累,并与之保持平衡(图 1)。1 P6C 与吡哆醛 5 0 -磷酸 (PLP) 形成复合物,后者是唯一一种可作为酶辅因子的 B 6 维生素单体,通过 Knoevenagel 缩合导致其失活。1 这导致生物可利用的 PLP 耗尽,而 PLP 是其作为辅因子进行各种反应所必需的,其中许多反应涉及神经递质代谢,并导致癫痫表型。尽管吡哆醇治疗对癫痫发作有反应,但长期神经认知功能障碍在高达 75% 的患者中会出现一定程度的发育迟缓,通常与早期治疗无关。2 除了补充吡哆醇外,限制赖氨酸和补充精氨酸的饮食也有助于降低 α -AASA/P6C 的神经毒性水平,但已显示出一些希望。3 ALDH7A1 还可以通过亚硫酸盐氧化酶 (SUOX) 或钼辅因子缺乏 (MoCD) 中积累亚硫酸盐来抑制,从而引起继发性 ALDH7A1 缺乏症。4-6
一种新颖的发现:1961年的Poly-U Matthaei-Nirenberg实验不能充当mRNA
表明,“ poly-u刺激了许多其他许多其他氨基酸纳入蛋白质,例如亮氨酸,异亮氨酸,苏胺,苏氨酸,精氨酸,精氨酸,组氨酸,赖氨酸,丝氨酸,色氨酸和脯氨酸””由poly-u刺激,也不知道为什么马特塞伊(Matthaei)和尼伦贝格(Nirenberg与苯丙氨酸相对应的聚-U刺激”意味着“总4个碱基的特异性”仅对应“总4种4种氨基酸”,而不是“总共20种氨基酸”。“特殊性”的概念是一个理论上的错误)。