XiaoMi-AI文件搜索系统
World File Search System免疫治疗在胃癌伴肝转移中的应用
治疗选择。这些治疗方法旨在提高患者的生活质量并扩大生存率,反映出胃癌管理及其肝转移的进步。这种意义的意义在于它的重点是肝转移如何影响免疫疗法在胃癌中的功效,这一问题既重要又紧急。尽管许多研究探索了胃癌的免疫疗法,但相对较少的特异性针对肝转移患者。本研究旨在解决这一差距并为临床决策提供信息。
基因转移技术与基因靶向性核素治疗
/)$ 0&%%%)-2%&)0/30&%)/0'b&:a&%#-3' - /3%)' - /3 e>/6 [/6 [/)+ [602+'&6 $ d kjk [/)+ v8至3/u3
巨大肝癌术后转移靶免治疗长期生存1例并文献复习
Figure 7.Chest CT scan 16 months after surgery: (A) Lung window shows multiple small nodular lesions in both lungs, with a high possibility of bilateral lung metastases, changes compared to previous scan not significant.(B) Bone window shows bone destruction at the posterior edge of the T8 vertebral body and its attachments, indicating a high possibility of bone me- tastasis; (C) and (D) are upper abdominal MR scans 16 months after surgery, showing a nodular abnormal signal shadow with a long diameter of approximately 33mm in the left adrenal area, with slight uneven enhancement.The nodular abnormal signal shadow in the left adrenal area has significantly increased compared to before, indicating a high possibility of metastatic tumor 图 7.术后 16 个月胸部 CT , (A) 肺窗示双肺多发小结节灶,考虑双肺转移瘤可能性大,较前变化不明显, (B) 骨窗 示约 T8 椎体后缘及附件骨质破坏,骨转移可能性大; (C) (D) 术后 16 个月上腹 MR ,左侧肾上腺区可见长径约 33 mm 的结节状异常信号影,不均匀轻度强化,左侧肾上腺区结节状异常信号影,较前明显增大,考虑转移瘤可能性大
SIM2REAL转移
• Domain randomization ( dynamics , visuals) • Learning to adapt the textures of the simulator to match the real domain • Learning to adapt the dynamics of the simulator to match the real domain • Learning from label images as opposed to pixel images-> semantic maps between simulation and real world are
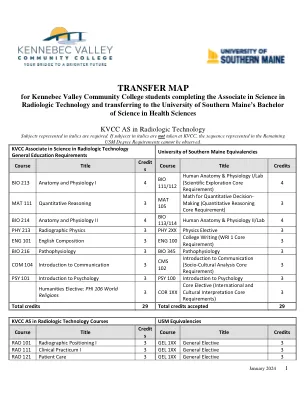
转移地图
RAD 102 Radiographic Positioning II 3 GEL 1XX General Elective 3 RAD 112 Clinical Practicum II 4 GEL 1XX General Elective 4 RAD 131 Radiographic Exposure 3 GEL 1XX General Elective 3 RAD 103 Radiographic Positioning III 2 GEL 1XX General Elective 2 RAD 113 Clinical Practicum III 4 GEL 1XX General Elective 4 RAD 211 Clinical Practicum IV 5 GEL 2XX General Elective 5 RAD 214 Ethics and Quality Assurance 1 GEL 2XX General Elective 1 RAD 220 Radiographic Exposure II 2 GEL 2XX General Elective 2 RAD 212 Clinical Practicum V 6 GEL 2XX General Elective 6 RAD 216 Introduction to Imaging Modalities 1 GEL 2XX General Elective 1 RAD 218 Radiation Biology and Protection 2 GEL 2XX General Elective 2 RAD 222 Senior Seminar for Radiologic Technology 2 GEL 2XX General选修2总学分