XiaoMi-AI文件搜索系统
World File Search SystemIMMUNICY-1:利用 CYAD-211 靶向 BCMA,建立基于 shRNA 的同种异体 CAR-T 细胞治疗平台的概念验证
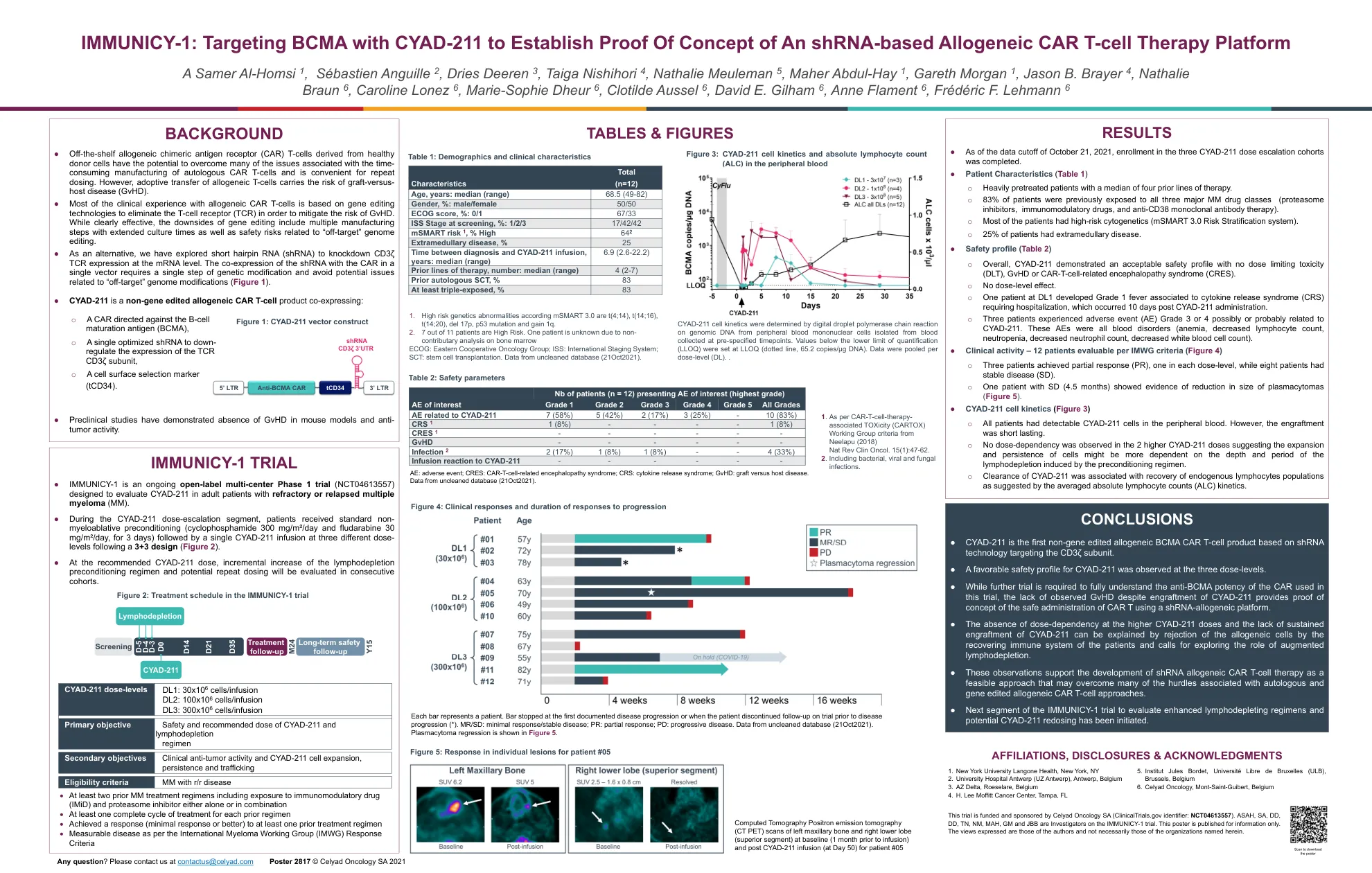
● 源自健康供体细胞的现成同种异体嵌合抗原受体 (CAR) T 细胞有可能克服自体 CAR T 细胞制造耗时带来的许多问题,并且便于重复给药。然而,同种异体 T 细胞的过继转移存在移植物抗宿主病 (GvHD) 的风险。
将工程共刺激疫苗与 NK 细胞相结合可诱导抗肿瘤作用
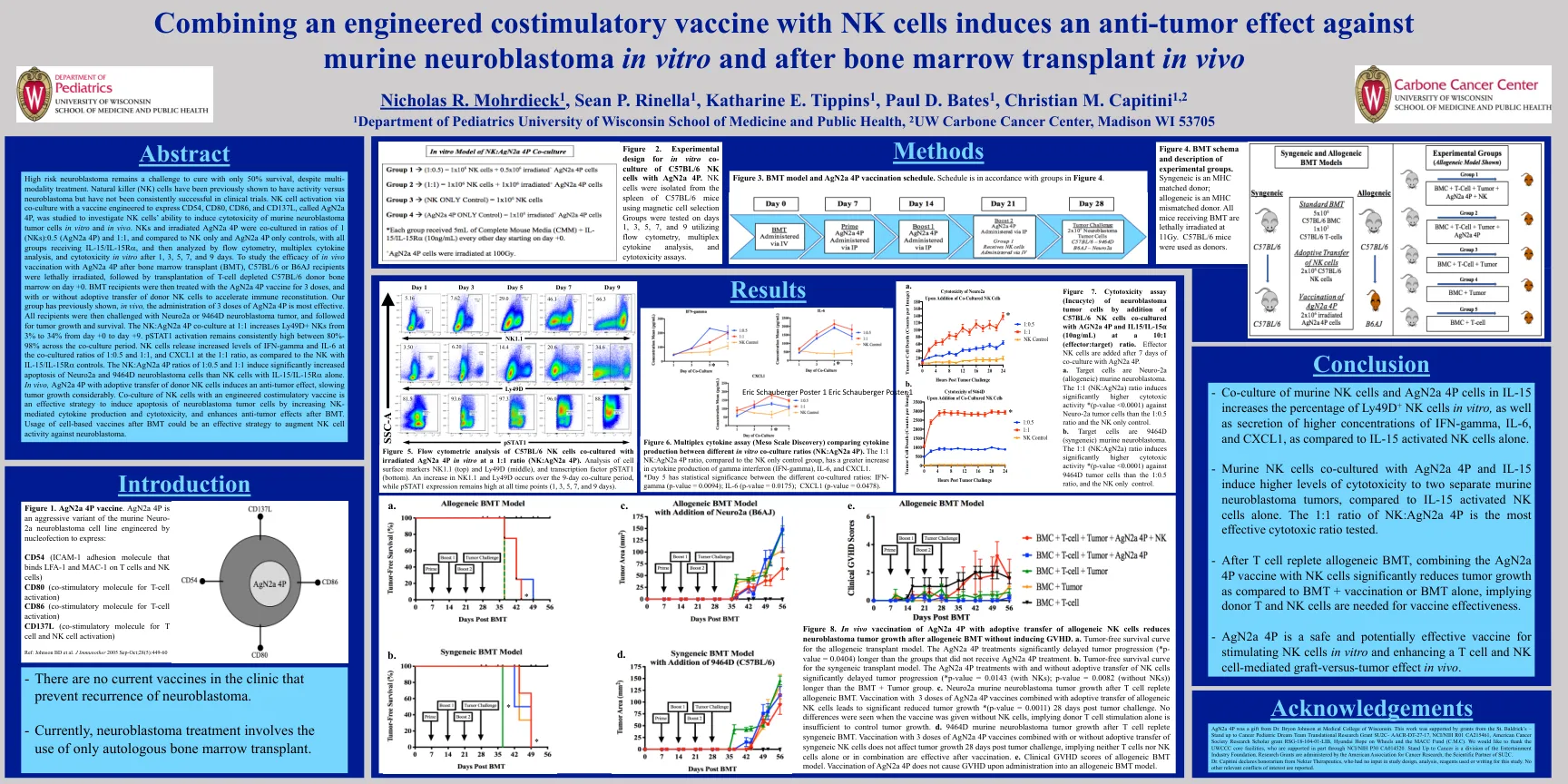
尽管采用多种治疗方法,高风险神经母细胞瘤的治愈率仍仅为 50%,仍然是一项挑战。此前已证明自然杀伤 (NK) 细胞对神经母细胞瘤具有活性,但在临床试验中并未取得一致成功。通过与经改造以表达 CD54、CD80、CD86 和 CD137L 的疫苗(称为 AgN2a 4P)共培养来激活 NK 细胞,研究了 NK 细胞在体外和体内诱导小鼠神经母细胞瘤肿瘤细胞细胞毒性的能力。 NK 细胞和辐照过的 AgN2a 4P 以 1 (NK 细胞):0.5 (AgN2a 4P) 和 1:1 的比例共培养,并与仅 NK 细胞和仅 AgN2a 4P 对照组进行比较,所有组均接受 IL-15/IL-15R a,然后在 1、3、5、7 和 9 天后通过流式细胞术、多重细胞因子分析和体外细胞毒性进行分析。为了研究骨髓移植 (BMT) 后体内接种 AgN2a 4P 的功效,对 C57BL/6 或 B6AJ 接受者进行致死性辐照,然后在 +0 天移植 T 细胞耗竭的 C57BL/6 供体骨髓。然后用 AgN2a 4P 疫苗治疗 BMT 接受者 3 剂,并且过继转移或不过继转移供体 NK 细胞以加速免疫重建。我们小组之前已证明,在体内,施用 3 剂 AgN2a 4P 最为有效。然后,所有接受者均接受 Neuro2a 或 9464D 神经母细胞瘤肿瘤的攻击,并跟踪肿瘤的生长和存活情况。NK:AgN2a 4P 以 1:1 的比例共培养,从第 +0 天到第 +9 天,Ly49D+ NK 的比例从 3% 增加到 34%。在整个共培养期间,pSTAT1 激活率始终保持在 80%-98% 的高水平。与 NK 与 IL-15/IL-15R a 对照相比,NK 细胞在共培养比例为 1:0.5 和 1:1 时释放的 IFN-γ 和 IL-6 水平增加,在 1:1 比例时释放的 CXCL1 水平增加。 NK:AgN2a 4P 比例为 1:0.5 和 1:1 时,与仅使用 IL-15/IL-15R a 的 NK 细胞相比,Neuro2a 和 9464D 神经母细胞瘤细胞的凋亡显著增加。在体内,AgN2a 4P 与供体 NK 细胞的过继转移可诱导抗肿瘤作用,显著减缓肿瘤生长。NK 细胞与工程共刺激疫苗共培养是一种有效的策略,可通过增加 NK 介导的细胞因子产生和细胞毒性来诱导神经母细胞瘤肿瘤细胞凋亡,并增强 BMT 后的抗肿瘤作用。BMT 后使用基于细胞的疫苗可能是增强 NK 细胞对抗神经母细胞瘤活性的有效策略。
淋巴细胞清除白皮书
淋巴细胞耗竭:具有急性毒性和对抗肿瘤免疫功能的长期有害后果的全身化疗。淋巴细胞耗竭在过继性 T 细胞疗法中的作用目前的过继性 T 细胞疗法,例如 CAR-T 细胞疗法,统一在一系列药物治疗后进行,这些药物治疗被称为淋巴细胞耗竭、淋巴细胞耗竭化疗或淋巴细胞耗竭方案。对患者实施淋巴细胞耗竭的明确目的是促进过继转移的 T 细胞的植入和扩增。淋巴细胞耗竭化疗的概念源自自体干细胞移植的概念。观察表明,在淋巴细胞水平非常低的患者中,过继转移的 T 细胞存活时间更长,扩增更强劲——这种状态称为“淋巴细胞减少症”。因此,研究过继细胞治疗方案的研究人员试图通过使用以前已知可以减少淋巴细胞计数的药物来复制淋巴细胞减少状态。由此产生的淋巴细胞清除方案旨在大幅减少多种宿主淋巴细胞的绝对数量和功能。淋巴细胞清除化疗具有多种作用机制,可促进过继细胞治疗的功能。其中,最重要的机制之一是减少对生长因子的竞争,从而使过继转移的细胞能够植入和扩增。淋巴细胞清除显著减少了吸收营养细胞因子和生长因子(决定免疫细胞稳态)的宿主淋巴细胞数量。因此,淋巴细胞清除释放了这些细胞因子,使其与进入的过继转移治疗性 T 细胞上表达的细胞因子和生长因子受体结合并激活这些受体,从而增强扩增和植入。此外,淋巴细胞清除可以减少宿主免疫系统对过继转移细胞的排斥,因为在供体来源的治疗细胞中,可能会对表达含有外来序列的转基因的自体细胞产生免疫反应或产生抗同种异体移植反应。然而,虽然目前的淋巴细胞清除方案可有效促进过继转移 T 细胞的植入和扩增,但释放的细胞因子和生长因子的数量在患者、肿瘤类型和特定淋巴细胞清除方案之间差异很大。这可能导致细胞治疗植入不稳定,治疗细胞扩增过快导致一些患者出现毒性事件,而另一些患者则出现 T 细胞扩增不理想和疗效不佳。很明显,虽然淋巴细胞清除化疗是当前过继细胞疗法联合介导疗效所必需的,但它增加了
唑来膦酸扩增的自体 Vγ9Vδ2 T 细胞在治疗难治性非小细胞肺癌患者中的过继转移:一项多中心、开放标签、单组、 2 期研究
摘要 背景 并非所有非小细胞肺癌 (NSCLC) 患者都具有药物可靶向的驱动突变,并且对免疫检查点阻断疗法的反应率也仍然不令人满意。 因此,仍然需要更有效的治疗方法。 在这里,我们报告了使用唑来膦酸扩增的自体 V γ 9V δ 2 T 细胞对治疗难治性 NSCLC 进行过继细胞疗法的 II 期临床试验的结果。 方法 这项开放标签、单组、多中心、II 期研究纳入了已接受至少两种标准化疗方案治疗无法切除的疾病或已接受至少一次包括化疗或放疗治疗术后复发疾病的治疗的 NSCLC 患者。 在初步测试 V γ 9V δ 2 T 细胞增殖后,将自体外周血单核细胞与唑来膦酸和 IL-2 一起培养以扩增 V γ 9V δ 2 T 细胞。每2周静脉注射一次培养细胞(>1×10 9 ),共注射6次。本研究的主要终点是无进展生存期(PFS),次要终点包括总生存期(OS)、最佳客观缓解率(ORR)、疾病控制率(DCR)、安全性和免疫监测。临床有效率定义为中位 PFS 显著 > 4 个月。结果 共入组 25 例患者(20 例腺癌、4 例鳞状细胞癌和 1 例大细胞癌)。25 例患者均接受了自体 V γ 9V δ 2 T 细胞治疗,其中 16 例完成了预定的6次培养细胞注射疗程。中位 PFS 为 95.0 天(95% CI 73.0 至 132.0 天);中位 OS 为 418.0 天(179.0–479.0 天),最佳总体反应为 1 例部分反应、16 例疾病稳定 (SD) 和 8 例疾病进展。ORR 和 DCR 分别为 4.0%(0.1%–20.4%)和 68.0%(46.5%–85.1%)。9 例患者发生严重不良事件,主要与疾病进展有关。1 例患者因 V γ 9V δ 2 T 细胞输注而出现肺炎和炎症反应,同时伴有巨大肿瘤消失。
PD-1 缺陷型黑色素瘤的抗肿瘤功效增强……
摘要背景基因组编辑为优化 T 细胞的功能特性以实现过继细胞转移目的提供了独特的视角。到目前为止,PDCD1 编辑已主要在嵌合抗原受体 T (CAR-T) 细胞和人类原代 T 细胞中成功测试。尽管如此,对于实体瘤患者,过继转移针对肿瘤抗原的效应记忆 T 细胞仍然是一种相关的选择,而使用缺乏程序性细胞死亡-1 (PD-1) 表达的高亲和力 T 细胞可能会提高这些治疗的治疗效果。方法在这里我们使用 CAS9/sgRNA 核糖核蛋白复合物的转染来编辑针对黑色素瘤抗原 Melan-A 的人类效应记忆 CD8 + T 细胞中的 PDCD1 基因。我们克隆了编辑的 T 细胞群,并通过每个 T 细胞克隆中的测序和流式细胞术验证了 PDCD1 编辑,以及 T 细胞受体 (TCR) 链的测序。我们还对野生型 (WT) 和编辑的 T 细胞克隆进行了全转录组分析。最后,我们通过在 NOD scid gamma (NSG) 小鼠中的过继转移,在体外和体内记录了表达相同 TCR 的 WT 和 PD-1KO T 细胞克隆的抗肿瘤特性。结果在这里,我们证明了在人类效应记忆黑色素瘤特异性 T 淋巴细胞中编辑 PDCD1 基因的可行性。我们表明,在 PDCD1 编辑的 T 细胞克隆上,PD-1 表达显著降低或完全缺失。对表达相同 TCR 并表现出相似功能亲和力的一组 T 细胞克隆的广泛表征表明,它们对表达 PD-L1 的黑色素瘤细胞系具有优异的抗肿瘤反应性。转录组分析显示,在 PD-1 缺陷的 T 细胞克隆中,参与增殖和 DNA 复制的基因下调,而参与代谢和细胞信号传导的基因上调。最后,我们证明了 PD-1 缺陷型 T 细胞在 NSG 小鼠模型中显著延缓 PD-L1 表达人类黑色素瘤生长的卓越能力。结论 将此类淋巴细胞用于过继细胞转移目的,结合其他调节肿瘤微环境的方法,将成为改善实体肿瘤免疫治疗效果的有希望的替代方法。
高效将 siRNA 递送至人类 NK 细胞的优化平台
自然杀伤 (NK) 细胞是先天淋巴细胞,参与针对病毒感染细胞和肿瘤的免疫反应 [1]。NK 细胞的功能可通过过继转移用于治疗,这是一种很有前途的癌症治疗选择 [2, 3]。我们对 NK 细胞如何感知周围环境、识别异常细胞和整合受体输入的理解已经取得了长足的进步 [4–6]。然而,产生和维持其功能能力的分子网络仍未完全了解,阐明 NK 细胞内在调控网络有望改善 NK 细胞治疗。通过电穿孔、脂质转染或病毒转导对 NK 细胞进行遗传操作受到传递效率不稳定和活力受损的限制(详见 [7])。已描述了使用 CRISPR/Cas9 进行 NK 细胞基因工程的效率,范围从 24% 到 90% [8–10],并且此类方法通常包括体外强力激活,从而排除了对仅在激活前表达或在激活后动态调节的基因的研究。RNA 干扰介导的基因表达敲低是一种有价值的
癌症基因和细胞治疗的新时代
用基因治疗治疗人类遗传病的理念早在50多年前就被提出(13)。尽管从理论到临床应用的道路漫长而充满挑战,但基因治疗为多种疾病的治疗提供了新的选择。成功的基因治疗已从直接体内注射病毒载体发展到过继转移基因工程细胞和基因组编辑(14)。1970年,斯坦菲尔德·罗杰斯(Stanfield Rogers)进行了首次人类基因治疗实验,他试图通过注射含有精氨酸酶的乳头瘤病毒来治疗2名高精氨酸血症儿童,但未能取得成功(15)。1999年,杰西·格尔辛格(Jesse Gelsinger)自愿参加费城宾夕法尼亚大学针对罕见遗传病鸟氨酸转氨甲酰酶缺乏症进行的基因治疗试验,但他在试验后不久就去世了(16)。2000年,首次成功的基因治疗试验临床结果发表,涉及严重联合免疫缺陷(SCID)-X1,为基因治疗铺平了道路。
消融 T 细胞相关 PD-1H 可增强功能并促进过继免疫治疗
程序性死亡-1 同源物 (PD-1H) 是一种共抑制分子,可负向调节 T 细胞介导的免疫反应。在本研究中,我们确定了 T 细胞相关 PD-1H 的消融是否可以增强实验性肿瘤模型中的过继性 T 细胞疗法。PD-1H 的表达在活化和肿瘤浸润性 CD8 + T 细胞中上调。PD-1H 缺陷 (PD-1H-KO) 小鼠的活化 CD8 + T 细胞在体外表现出细胞增殖、细胞因子产生和抗肿瘤活性增加。PD-1H-KO CD8 + T 细胞的过继转移导致已建立的同源小鼠肿瘤消退。当通过 CRISPR/Cas9 介导的基因沉默在 T 细胞中消融 PD-1H 时获得了类似的结果。此外,CAR-T 细胞中 PD-1H 的消融显著提高了其对体内人类异种移植物的抗肿瘤活性。我们的结果表明,T 细胞相关的 PD-1H 可以抑制肿瘤微环境中的免疫力,并且针对 PD-1H 可能会改善 T 细胞过继免疫疗法。
癌症生物学年度回顾:人源化小鼠模型用于评估癌症免疫疗法
免疫疗法是癌症治疗的前沿。许多新型癌症免疫疗法的出现,包括免疫检查点抗体、CAR(嵌合抗原受体)T 细胞和 TCR(T 细胞受体)T 细胞的过继转移、NK(自然杀伤)细胞、T 细胞接合剂、溶瘤病毒和疫苗,正在彻底改变不同类型肿瘤的治疗方法。一些方法已在临床上使用,还有许多其他方法正在进行中。然而,并非所有患者都有反应,会产生耐药性,而且随着可用疗法的增多,需要进一步了解它们的工作原理、如何优先考虑它们的临床评估以及如何将它们结合起来。为此,动物模型发挥了重要作用,人源化小鼠模型(即植入人类免疫细胞和癌细胞的免疫缺陷小鼠)代表了向前迈出的一步,尽管它们有几个局限性。在这里,我们回顾了当今可用的不同类型的人源化模型、克服其缺陷的方法、它们在评估癌症免疫疗法中的应用,以及它们作为帮助个性化临床决策的工具的预期发展。
CRISPR-Cas9 核糖核蛋白介导的成熟原代先天免疫细胞中的基因组编辑
CRISPR 基因组工程已成为一种功能性研究免疫系统调节复杂机制的强大工具。尽管数十年来一直致力于对先天免疫进行遗传重编程,但当前方法的实用性受到体内成熟细胞谱系的敲除效率低或特异性有限的限制。在这里,我们描述了一种优化的非病毒 CRISPR-Cas9 核糖核蛋白 (cRNP) 基因组编辑策略,该策略可对成熟的原代小鼠先天淋巴细胞 (ILC) 和髓系细胞进行基因组编辑,从而导致单次电穿孔导致单或双靶基因表达几乎完全丧失。此外,我们描述了体内过继转移小鼠模型,该模型可用于使用 cRNP 编辑的幼稚自然杀伤 (NK) 细胞和骨髓衍生的常规树突状细胞前体 (cDCP) 筛选病毒感染期间的基因功能。该资源将增强靶基因发现,并为小鼠先天免疫系统中的基因编辑提供一种特定且简化的方法。