XiaoMi-AI文件搜索系统
World File Search System与您的迷走神经成为朋友:儿童故事书
该论文是由DigitalCommons@Lesley的艺术与社会科学研究生院(GSASS)免费提供给您的。已被DigitalCommons@Lesley的授权管理员纳入正念研究。有关更多信息,请联系digitalcommons@lesley.edu,cvrattos@lesley.edu。
迷走神经,发展和格雷的动机理论
摘要在过去的十年中,心脏迷走神经张力已成为儿童和成人行为功能许多方面的心理生理标记。在此期间的研究工作产生了广泛的迷走神经相关性列表,其中包括气质变量以及焦虑/内在化和破坏性/外部化行为。这种可能令人困惑的事务状态与迷走神经关系的发展转变相比,迄今尚未阐明。在本文中,审查了迷走神经的文献,包括缺乏迷走神经作为心理生理学标记的差异。这样的澄清要求我们(a)在发育环境中查看迷走神经 - 行为关系,(b)并置迷走神经态 - 典型和非典型样本中的行为关系 - (c)考虑在更广泛的自主神经系统功能的更广泛模型中,模型的副交感神经上的副交感神经上层是一种。通过将灰色的动机理论与Porges的多面化理论相结合来提供这样的模型。这些模型共同说明了在各种心理疾病范围内的行为和情感差异,这些疾病并非仅通过任何模型而分化。此外,使用综合模型为研究自主神经系统与行为关系的研究提供了一种理论驱动的方法。
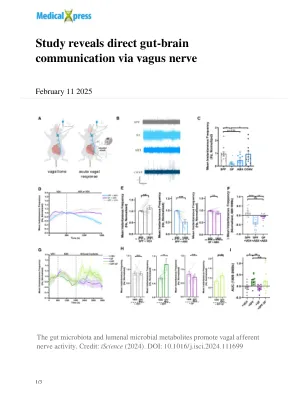
研究揭示了通过迷走神经的直接肠道通信
长期以来,人们一直认为迷走神经可以促进肠道微生物组(生活在肠道中的微生物社区)之间的交流,而大脑的直接证据是有限的。詹姆森(Jameson)领导的研究人员观察到,与患有正常肠道肠道微生物组的小鼠相比,没有任何肠道细菌(称为无菌小鼠)的小鼠在迷走神经中表现出明显较低的活性。值得注意的是,当将这些无菌小鼠引入正常小鼠的肠道细菌时,它们的迷走神经活性增加到正常水平。
引起创伤后应激障碍的迷走神经刺激
最初被批准用于治疗癫痫的迷走神经刺激(VNS)包括通过迷走神经(第十颅神经)间接刺激神经网络。vns通常涉及一种侵入性程序,其中脉冲发生器(类似于起搏器)植入了患者胸部的皮肤下方,连接到颈部左迷走神经上的电极通过电气线连接(VA/DOD,2016年)。植入后,脉冲发生器由计算机控制,并编程为每天24小时(通常每五分钟30秒)定期发送电动冲动,通常为十周的时间。最近,已经开发出了新型的无创VNS设备,从而可以外部刺激迷走神经(Bremner等,2020)。VNS is a U.S. Food and Drug Administration (FDA)-approved intervention for treatment-resistant depression (FDA, 2005), and is being evaluated as a potential treatment for other mental health disorders, including obsessive compulsive disorder (OCD), schizophrenia, panic disorder (PD), and posttraumatic stress disorder (PTSD; Cimpianu, Strube, Falkai, Palm, & Hasan, 2016)。
通过耳朵对迷走神经进行经皮电刺激
本报告概述了通过非侵入性经皮耳迷走神经刺激 (taVNS) 对自主神经系统进行电神经调节的科学文献。使用常用的经皮神经电刺激设备 (TENS),可以通过耳朵以非侵入性、安全的方式电刺激迷走神经。近年来,已经发表了大量临床前和临床研究,描述了 taVNS 的作用机制及其潜在的临床用途,特别是作为各种医疗条件的辅助治疗。主要作用机制似乎是 taVNS 可以降低交感神经紧张、具有抗炎作用、增加中枢神经系统的可塑性、并改变大脑不同部位之间的神经传递和功能连接。通过耳朵刺激迷走神经可以给患者提供良好的安全性,并且操作简单、轻柔,成本低。
肠道粘膜细胞将α-突触核蛋白转移到迷走神经
引言帕金森氏病(PD)是一种使人衰弱的神经退行性疾病,具有特征性运动障碍,包括刚度,静止震颤和胸肌。许多患者还患有胃肠道症状,例如便秘,通常在特征运动缺陷之前10年或更长时间(1)。PD的病态标志是细胞内蛋白质夹杂物,填充了α-突触核蛋白的纤维化形式,它们在大脑和周围神经系统中均积累。在PD的多巴胺能神经元中,称为Lewy身体的包含物与神经元脆弱性和变性有关(2,3)。贯穿大脑,通常在兴奋性神经元和其他神经元亚型的突触前末端发现α-突触核蛋白,在内吞作用和突触囊泡功能中起作用(4)。 在α-突触核蛋白基因(SNCA)(例如A53T和A30P)以及SNCA基因座的乘法中可能引起家族性PD(5,6)。 α-突触核蛋白蛋白的显着特征之一是将汇总成β-薄片 - 富含蛋白质原纤维的内在能力,这些能力对硫非激素等淀粉样蛋白染料具有很高的亲和力(7-9)。 这些α-突触核蛋白原纤维具有提议的能力,可以在假设的prion样级联反应中扩散相互联系的细胞(10-13)。 转移的α-突触核蛋白可能会在受体细胞中募集天然α-突触核蛋白,从而播种额外的凝结物(14-16),可以形成较大的原纤维和夹杂物(17、18)。 α-突触核蛋白RT Quic分析在DuodeNal活检中证明了PD患者但没有健康对照组的播种活性(20)。贯穿大脑,通常在兴奋性神经元和其他神经元亚型的突触前末端发现α-突触核蛋白,在内吞作用和突触囊泡功能中起作用(4)。在α-突触核蛋白基因(SNCA)(例如A53T和A30P)以及SNCA基因座的乘法中可能引起家族性PD(5,6)。α-突触核蛋白蛋白的显着特征之一是将汇总成β-薄片 - 富含蛋白质原纤维的内在能力,这些能力对硫非激素等淀粉样蛋白染料具有很高的亲和力(7-9)。这些α-突触核蛋白原纤维具有提议的能力,可以在假设的prion样级联反应中扩散相互联系的细胞(10-13)。转移的α-突触核蛋白可能会在受体细胞中募集天然α-突触核蛋白,从而播种额外的凝结物(14-16),可以形成较大的原纤维和夹杂物(17、18)。α-突触核蛋白RT Quic分析在DuodeNal活检中证明了PD患者但没有健康对照组的播种活性(20)。通过新开发的种子聚集试验(包括蛋白质错误折叠的循环扩增和实时Quaking诱导的转换(RT-QUIC)ASSAINS(19),在PD中的存在和脑脊液中的α-突触蛋白原纤维和脑脊液的温度活性已被令人信服地证明。在该测定中触发活性的α-突触核蛋白种子的起源尚不清楚。在大鼠模型中,人们认为触发α-突触核蛋白的病理积累的种子可能起源于神经元和大脑,并落入肠道或肠道中的某个地方并升入大脑(21)。
基因座的特征与耐药性癫痫中迷走神经刺激反应有关
基因座 - 呼吸肾上腺素系统被认为与迷走神经刺激的临床作用有关。已知该系统可防止癫痫发育并引起长期塑性变化,尤其是随着海马中去甲肾上腺素的释放。然而,成为治疗者和作用机理的必要条件仍在研究中。使用MRI,我们评估了层层基因座的结构和功能特征以及在耐药药物或对治疗不反应的耐药性癫痫患者中白质层层层的微观结构特性。在这项试验研究中招募了23例抗药性癫痫患者宫颈神经刺激患者,其中包括13名响应者或部分响应者和10名无反应者。专用的结构MRI获取允许在体内定位层层层和其对比度的计算(LC完整性的公认标记)。基因座二氧化合物活动。最后,使用多壳扩散MRI来估计基因座 - 海马域的结构特性。比较了响应者/部分响应者和非反应者之间的这些特征,还探讨了它们与治疗持续时间的关联。在对治疗反应更好的患者中,分别在肠层基因座的左侧和右尾部分中发现了较低活性和较高对比度的趋势。最后,发现了较高的基因座 - 海马连接在其内侧部分双侧的二氧对比度增加,与治疗持续时间相关。
右迷走神经刺激通过发挥神经保护作用改善帕金森病大鼠的运动行为
近期研究发现迷走神经与中脑多巴胺能神经元之间存在关联。对啮齿类动物肠脑神经环路的研究发现,迷走神经与中脑多巴胺能神经元之间存在环路(6,7),证实了帕金森病源自肠道的研究,即帕金森病的发病机制与胃肠神经系统有关,迷走神经通过传导至中脑多巴胺能神经元(8-10)。先前的研究还显示,电刺激迷走神经会影响大鼠中脑多巴胺能区域的大分子结构和元素组成(11,12)。此外,迷走神经刺激可以增加大鼠中脑多巴胺能神经元中 c-Fos 的表达(13)。一项针对人类大脑的神经影像学研究表明,迷走神经刺激也能激活中脑多巴胺能区域(14)。这些发现为通过迷走神经治疗帕金森病提供了研究基础
经皮耳廓迷走神经刺激治疗意识障碍的现状与展望
意识障碍(DOC)是目前尚无公认治疗方法的神经系统疾病之一。DOC的发病机制尚不明确,涉及多种难以区分的疾病类型,误诊率高,预后不良。大多数治疗方法仍有待未来明确,以提供足够的证据来指导临床。神经调节技术旨在更直接地调节神经回路以促进觉醒。目前,已证实经皮耳迷走神经刺激(taVNS)作为一种治疗工具的潜力值得在意识障碍的背景下探索,就像先前提出的侵入式VNS一样,其中刺激迷走神经改变与意识相关的大脑区域的手段也受到了广泛的关注。在本文中,我们回顾了taVNS和DOC的文献,以更好地了解taVNS作为一种对单个受试者具有敏感性和/或特异性的非侵入性神经调节方法的现状和发展前景。
肠脑迷走神经轴影响海马记忆过程和可塑性
迷走神经是身体和大脑之间的内感受中继。尽管迷走神经在摄食行为、能量代谢和认知功能中的作用已得到充分证实,但连接迷走神经和海马的复杂功能过程及其对学习和记忆动态的贡献仍然难以捉摸。在这里,我们研究了肠脑迷走神经轴是否以及如何在行为、功能、细胞和分子水平上促进海马的学习和记忆过程。我们的结果表明,迷走神经轴的完整性对于长期识别记忆至关重要,同时对其他形式的记忆也有保护作用。此外,通过结合多尺度方法,我们的研究结果表明肠脑迷走神经张力在扩大细胞内信号事件、基因表达、海马树突棘密度以及功能性长期可塑性 (LTD 和 LTP) 方面发挥着允许作用。这些结果强调了肠脑迷走神经轴在维持海马群的自发和稳态功能以及调节其学习和记忆功能方面的关键作用。总之,我们的研究全面了解了肠脑迷走神经轴在塑造时间依赖性海马学习和记忆动态方面的多方面参与。了解这种内感受性身体-大脑神经元通讯背后的机制可能为与认知衰退相关的疾病(包括神经退行性疾病)的新治疗方法铺平道路。