XiaoMi-AI文件搜索系统
World File Search System文章
背景:抗生素给药会导致肠道菌群和免疫系统改变影响健康。牛乳铁蛋白是一种牛奶蛋白,具有抗癌,抗炎,抗菌和免疫调节剂活性。的目的是研究天然和铁饱和乳铁蛋白逆转木林霉素对鼠模型中肠道霉素对肠道微生物群和肠收缩受体(TLRS)表达的影响的能力。方法:雄性C57BL/6小鼠用媒介物,克林霉素(Clin),本地牛乳酸铁蛋白(NLF),NLF + Clindamycin(NLF_Clin),铁饱和的牛乳脂素(SLF)和SLF + Clindamycin(SLF + clindamycin(Slf_clin(Slf_clin))。粪便样品,并提取细菌DNA。进行了16S rRNA V4高变量基因区域的测序以评估微生物组成。通过qPCR在小鼠结肠中测定TLR的mRNA表达水平(1-9)。 Pearson相关测试是在细菌之间进行的,显示样品之间的丰度差异,TLR2,TLR8和TLR9。 结果:β多样性分析表明,车辆的微生物群落与Clin,NLF_Clin和SLF_Clin的社区不同。 在家庭一级,临床组的细菌科,prevotellaceae和rikenellaceae降低,使用NLF或SLF的治疗恢复了这些影响。 临床降低了TLR2,TLR8和TLR9和SLF的表达,从而恢复了这些受体表达的降低。 最后,TLR8与Rikenellaceae的丰度正相关。通过qPCR在小鼠结肠中测定TLR的mRNA表达水平(1-9)。Pearson相关测试是在细菌之间进行的,显示样品之间的丰度差异,TLR2,TLR8和TLR9。结果:β多样性分析表明,车辆的微生物群落与Clin,NLF_Clin和SLF_Clin的社区不同。在家庭一级,临床组的细菌科,prevotellaceae和rikenellaceae降低,使用NLF或SLF的治疗恢复了这些影响。临床降低了TLR2,TLR8和TLR9和SLF的表达,从而恢复了这些受体表达的降低。最后,TLR8与Rikenellaceae的丰度正相关。结论:在克林霉素引起的肠道营养不良的情况下,乳铁蛋白恢复了某些抗炎细菌和TLR的正常水平,因此可能是添加到功能性食品中的好成分。
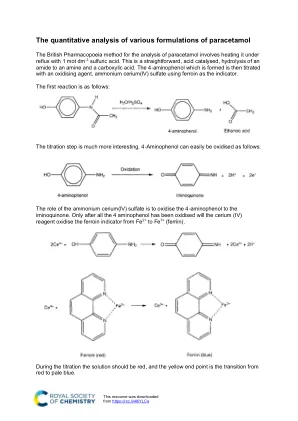
对扑热息痛的各种配方的定量分析
对扑热息痛的各种配方的定量分析英国药典方法用于分析扑热息痛,涉及将其用1 MOT DM -3 -3 -3硫酸在反流下加热。这是一种直接的,酸催化的,将酰胺水解为胺和羧酸。然后用氧化剂,硫酸铵(LV)硫酸盐使用铁蛋白作为指示剂,将形成的4-氨基苯酚滴定。第一个反应如下:
成人发病
1。efthimiou P,Paik PK,Bielory L.成人发病的诊断和人物。Ann Rheum Dis 2006; 65:564-72。2。Efthimiou P,Kontzias A,Hur P等。成人发病的焦点是:临床表现,诊断,治疗和未满足的靶向疗法时代。semin关节炎流变2021; 51:858-74。3。Yamaguchi M,Ohta A,Tsunematsu T等。 成人分类的预定标准。 J Rheumatol 1992; 19:424-30。 4。 Ichida H,Kawaguchi Y,Sugiura T等。 成人发作的静止病的临床表现与侵蚀性关节炎相关:与铁蛋白和白介素-18的水平较低。 关节炎护理Res(Hoboken)2014; 66:642-6。 5。 Bindoli S,Baggio C,Doria A等。 成人发病的疾病(AOSD):了解病理生理学,遗传学和新兴治疗方案的进展。 药物2024; 84:257-74。Yamaguchi M,Ohta A,Tsunematsu T等。成人分类的预定标准。J Rheumatol 1992; 19:424-30。4。Ichida H,Kawaguchi Y,Sugiura T等。 成人发作的静止病的临床表现与侵蚀性关节炎相关:与铁蛋白和白介素-18的水平较低。 关节炎护理Res(Hoboken)2014; 66:642-6。 5。 Bindoli S,Baggio C,Doria A等。 成人发病的疾病(AOSD):了解病理生理学,遗传学和新兴治疗方案的进展。 药物2024; 84:257-74。Ichida H,Kawaguchi Y,Sugiura T等。成人发作的静止病的临床表现与侵蚀性关节炎相关:与铁蛋白和白介素-18的水平较低。关节炎护理Res(Hoboken)2014; 66:642-6。5。Bindoli S,Baggio C,Doria A等。成人发病的疾病(AOSD):了解病理生理学,遗传学和新兴治疗方案的进展。药物2024; 84:257-74。
一种基于铁蛋白的 COVID-19 纳米颗粒疫苗,可在非人类灵长类动物中引发强效、持久、广谱的中和抗血清
图 1 – DCFHP 设计和验证。(A) DCFHP 示意图以红色显示了将 S∆C-Fer 转化为 DCFHP 所做的修改。受体结合域 (RBD)、N 端域 (NTD)、S1/S2 切割位点、S2' 切割位点、融合肽 (FP)、七肽重复 1 (HR1),如注释所示。(B) SDS-PAGE 凝胶显示纯化的 DCFHP 以单体形式运行,分子量达到预期的 kDa(梯形图,左侧显示)。(C) 从 SEC-MALS 确定的 UV(黄色)和光散射(灰色)轨迹显示了均匀的纳米颗粒峰,其近似分子量(虚线)为 3.4MDa。(D) DCFHP 的 3D 重建低温电子显微镜密度图,采用八面体对称性细化。 (E) 用 S∆C-Fer 或 DCHFP(由 500 µg 明矾和 20 µg CpG 1826 配制)免疫小鼠后,第 21 天血清对武汉-1 SARS-CoV-2 假病毒具有类似的强效中和作用,单次免疫后即可达到。在表达 ACE2 和 TMPRSS2 的 HeLa 细胞系中评估中和滴度。10 只小鼠的数据以几何平均滴度和标准差表示。测定定量限 (LOQ) 显示为虚线水平线。
炎症标记,血清铁蛋白和高灵敏性C反应性蛋白与HbA1c和血脂异常的相关性在2型糖尿病患者中
背景:糖尿病(DM)是一种影响胰岛素分泌,胰岛素敏感性或两者兼而有之导致高血糖的代谢疾病。随着它的进行,几乎所有系统包括心血管,神经,肾脏等。最终表现为几种与健康相关的并发症。随着人体的所有系统相互和谐,胰岛素抵抗,血脂异常的发展以及慢性炎症状态的设置得到了炎症标记的升高所证明的。的目的和目标:这项研究的目的是建立炎症标志物,血清铁蛋白和高灵敏度C反应蛋白(HS-CRP)与糖化血红蛋白(HBA1C)和2型DM型患者的血脂异常的相关性。材料和方法:目前的横断面研究是在贾坎德邦兰奇的拉金德拉医学科学研究所生物化学系进行的。研究中包括40至60岁的2型DM患者,血液HBA1C水平超过6.5%。结果:发现炎症标志物HS-CRP和铁蛋白与HBA1C,甘油三酸酯,总胆固醇和低密度脂蛋白 - 胆固醇呈正相关,但与高密度脂蛋白 - 胆固醇相关。结论:在糖尿病相关并发症(如动脉粥样硬化和心肌梗死)发展之前,在早期糖尿病患者中,糖尿病患者的持续炎症和自由基介导的损害估计可以检测持续的炎症性和自由基介导的损害。
基因组引入的含义和教训...
胃癌仍然是全球癌症死亡率的主要因素之一,尽管诊所中没有有希望的靶标药物。因此,紧急鉴定出新的针对胃癌的靶向药物。是诱导胃癌治疗的铁铁作用的有前途的策略,该诱导剂是一种潜在的药物。尽管如此,尚未进入诊所。因此,我们的目的是使用药物重新利用策略来鉴定一种用于胃癌治疗的新型铁铁作用诱导剂。首先,使用商业化复合文库的药物重新利用策略,小分子生物活性catsper通道阻滞剂HC-056456的特征是抑制胃癌生长MGC-803的生长。同时,这种抗增殖作用可以被铁蛋白1(一种抑制剂铁蛋白-1)阻止,表明HC-056456是一种诱导HC-056456。然后,鉴定出HC-056456通过p53/slc7a11信号通路降低GSH含量。然后,当细胞暴露于HC-056456时,累积了Fe 2+和脂质过氧化物。最后,发现HC-056456通过增加p53并在体内抑制SLC7A11,但在Ferrostatin-1的存在下抑制了SLC7A11,从而抑制了胃癌细胞的生长。总的来说,我们系统地阐明了HC-056456通过在体外和体内引起的铁毒性作用,从而发挥抗震颤癌症的作用,这表明其在胃癌治疗中的潜在作用。
注射:药物 F 政策
Ferumoxytol 由超顺磁性氧化铁组成,表面包裹一层碳水化合物外壳,有助于将生物活性铁与血浆成分隔离,直到铁-碳水化合物复合物进入肝脏、脾脏和骨髓的网状内皮系统巨噬细胞。铁从巨噬细胞囊泡内的铁-碳水化合物复合物中释放出来。然后,铁要么进入细胞内储存铁池(例如铁蛋白),要么转移到血浆转铁蛋白中,然后转运到红细胞前体细胞中,并被纳入血红蛋白。
无佐剂自组装铁蛋白纳米颗粒疫苗与携带 M1 和 PADRE 表位的流感病毒血凝素蛋白结合可引发交叉保护性免疫反应
结果:我们生产了一种不含佐剂的自组装纳米颗粒疫苗,可对抗多种甲型流感病毒。这种纳米颗粒疫苗在幽门螺杆菌铁蛋白表面显示多抗原靶点,该铁蛋白由 H3N2 病毒血凝素的胞外域和三个串联高度保守的甲型流感病毒 M1 表位组成,这些表位与通用辅助 T 细胞表位 PADRE 融合,称为 HMP-NP。HMP-NP 在杆状病毒-昆虫细胞系统中以可溶形式表达,并自组装成均质纳米颗粒。动物免疫研究表明,HMP-NP 纳米疫苗引起的血凝抑制 (HAI) 滴度比灭活甲型流感疫苗高 4 倍。 HMP-NPs 对 H3N2 病毒和 H1N1 和 H9N2 病毒异源株诱导的中和滴度分别比灭活流感疫苗高约 8、12.4 和 16 倍。同时,我们还观察到 HMP-NPs 诱导的 IFN-γ 和 IL-4 分泌细胞数量比灭活流感疫苗高约 2.5 倍。重要的是,使用 HMP-NPs 进行鼻内免疫(不使用任何佐剂)可诱导有效的粘膜 IgA 反应并赋予对 H3N2 病毒的完全保护,以及对 H1N1 和 H9N2 病毒的部分保护,并显着降低肺病毒载量。
在危地马拉农村的婴儿中,多种微量营养素强化饮料和响应式护理干预措施对儿童早期发育,血红蛋白和铁蛋白的影响
1美国马里兰州医学院儿科,美国马里兰州21201; akowalski@som.umaryland.edu 2asociaciónpara la para la para ladevención y estudio del vih/sida,Retalhuleu 11001,危地马拉; valfonso@apevihs.org(v.a.m. ); shdepster@gmail.com(S.D.P.) 3美国马里兰州巴尔的摩市约翰·霍普金斯公共卫生学院国际卫生部,美国马里兰州21205; kaley.lambden@gmail.com(k.b.l.) 4美国马里兰州马里兰州医学院流行病学和公共卫生系,美国马里兰州21202; natilton@gmail.com 5美国俄亥俄州代顿市人类营养促进研究所,美国俄亥俄州45414; lisa@chispuditos.com(l.m.v. ); apalacios@georgiasouthern.edu(A.M.P. ); reinhart.greg@gmail.com(g.a.r。) 6 Jiann Ping HSU公共卫生学院,佐治亚州南部大学,乔治亚州州立大学,乔治亚州30458,美国7 RTI国际,研究三角公园,美国北卡罗来纳州27709,美国 *通信:mblack@som.umaryland.edu†这些作者对这项工作做出了同样的贡献。1美国马里兰州医学院儿科,美国马里兰州21201; akowalski@som.umaryland.edu 2asociaciónpara la para la para ladevención y estudio del vih/sida,Retalhuleu 11001,危地马拉; valfonso@apevihs.org(v.a.m.); shdepster@gmail.com(S.D.P.)3美国马里兰州巴尔的摩市约翰·霍普金斯公共卫生学院国际卫生部,美国马里兰州21205; kaley.lambden@gmail.com(k.b.l.) 4美国马里兰州马里兰州医学院流行病学和公共卫生系,美国马里兰州21202; natilton@gmail.com 5美国俄亥俄州代顿市人类营养促进研究所,美国俄亥俄州45414; lisa@chispuditos.com(l.m.v. ); apalacios@georgiasouthern.edu(A.M.P. ); reinhart.greg@gmail.com(g.a.r。) 6 Jiann Ping HSU公共卫生学院,佐治亚州南部大学,乔治亚州州立大学,乔治亚州30458,美国7 RTI国际,研究三角公园,美国北卡罗来纳州27709,美国 *通信:mblack@som.umaryland.edu†这些作者对这项工作做出了同样的贡献。3美国马里兰州巴尔的摩市约翰·霍普金斯公共卫生学院国际卫生部,美国马里兰州21205; kaley.lambden@gmail.com(k.b.l.)4美国马里兰州马里兰州医学院流行病学和公共卫生系,美国马里兰州21202; natilton@gmail.com 5美国俄亥俄州代顿市人类营养促进研究所,美国俄亥俄州45414; lisa@chispuditos.com(l.m.v. ); apalacios@georgiasouthern.edu(A.M.P. ); reinhart.greg@gmail.com(g.a.r。) 6 Jiann Ping HSU公共卫生学院,佐治亚州南部大学,乔治亚州州立大学,乔治亚州30458,美国7 RTI国际,研究三角公园,美国北卡罗来纳州27709,美国 *通信:mblack@som.umaryland.edu†这些作者对这项工作做出了同样的贡献。4美国马里兰州马里兰州医学院流行病学和公共卫生系,美国马里兰州21202; natilton@gmail.com 5美国俄亥俄州代顿市人类营养促进研究所,美国俄亥俄州45414; lisa@chispuditos.com(l.m.v.); apalacios@georgiasouthern.edu(A.M.P.); reinhart.greg@gmail.com(g.a.r。)6 Jiann Ping HSU公共卫生学院,佐治亚州南部大学,乔治亚州州立大学,乔治亚州30458,美国7 RTI国际,研究三角公园,美国北卡罗来纳州27709,美国 *通信:mblack@som.umaryland.edu†这些作者对这项工作做出了同样的贡献。6 Jiann Ping HSU公共卫生学院,佐治亚州南部大学,乔治亚州州立大学,乔治亚州30458,美国7 RTI国际,研究三角公园,美国北卡罗来纳州27709,美国 *通信:mblack@som.umaryland.edu†这些作者对这项工作做出了同样的贡献。