XiaoMi-AI文件搜索系统
World File Search System使用 CRISPR/Cas9 在成纤维细胞 NIH3T3 中进行 BMPR2 编辑 (...
肺血管内皮细胞和平滑肌细胞功能障碍,以及肺血管内皮细胞和平滑肌细胞的进行性增生导致肺血管闭塞。(3)遗传变异是与肺动脉高压相关的重要因素之一。据推测与肺动脉高压有关的主要基因是骨形态发生蛋白受体Ⅱ(BMPR2)。超过80%的肺动脉高压患者和6-40%的特发性肺动脉高压患者有BMPR2突变。(4-7)肺动脉高压的发展与BMPR2功能改变或BMPR2表达降低有关。(8)原发性(特发性)和家族性肺动脉高压患者均显示BMPR2蛋白表达降低。继发性肺动脉高压患者的血管中 BMPR2 的表达也较低。(9) 已发现与肺动脉高压相关的 BMPR2 的几种突变,包括无义突变、错义突变、移码突变和显著的基因重排。(10) BMPR2 属于转化生长因子β (TGF-β) 细胞信号传导超家族。除 TGF-β 外,BMPR2 还有几种其他配体,如骨形态发生蛋白 (BMP) 和几种生长分化因子。(8) 先前进行的综述表明,BMPR2 缺陷与血管内膜厚度增加有关。(11) 肺动脉内皮细胞 (PAEC) 中敲除 BMPR2 会增加 PAEC 凋亡。使用 siRNA 沉默 PAEC 中的 mRNA BMPR2 也会增加 PAEC 的增殖和迁移。(12-13) 在肺平滑肌细胞 (PASMC) 中,BMPR2 是 PAH 发展的重要因素,包括两个主要方面:增殖增加和凋亡减少。BMPR2 信号失调与 PAH 中的平滑肌细胞 (SMC) 的特征有关。(14) 然而,关于 BMPR2 缺乏对成纤维细胞的影响的数据有限,成纤维细胞是血管壁结构的主要成分之一。
c-MET-HGF 轴在非小细胞肺癌肿瘤免疫学和免疫治疗中的新兴作用
c-MET 是一种酪氨酸激酶受体,具有通过二硫键连接的胞外 α 链和跨膜 β 链。在稳定状态下,该受体主要存在于上皮细胞中,它在细胞中调节细胞运动和增殖 (1)。c-MET 的配体是肝细胞生长因子 (HGF),它由间充质细胞以无活性形式产生 (1)。HGF 的激活需要丝氨酸蛋白酶的作用,这发生在组织损伤的局部区域 (2)。已证实多种人类癌症中存在异常的 c-MET 信号转导,这是由于 c-MET 受体过表达、受体突变或扩增、HGF 过表达或形成异常的自分泌信号转导所致的 (3)。癌症中的 c-MET 激活会促进;间充质细胞和上皮细胞之间的通讯、组织浸润、癌细胞增殖和血管生成诱导(1、4-6)。此外,选择性抑制或 SiRNA 敲低 c-MET 可降低非小细胞肺癌 (NSCLC) 细胞的活力,表明 c-MET 可直接促进肿瘤生长 (7)。在肺腺癌中,已发现各种错义突变和可变剪接产物。这些包括外显子 14 剪接突变,它导致受体降解减少和 c-MET 受体激活延长,据报道发生在 3% 的肺腺癌和 2.3% 的其他肺肿瘤中 (8)。Frampton 等人的体外研究支持外显子 14 剪接突变肿瘤将对抗 c-MET 疗法有反应的结论。来自三例患者的病例报告也提供了有限的临床数据来支持这一结论(8)。还有
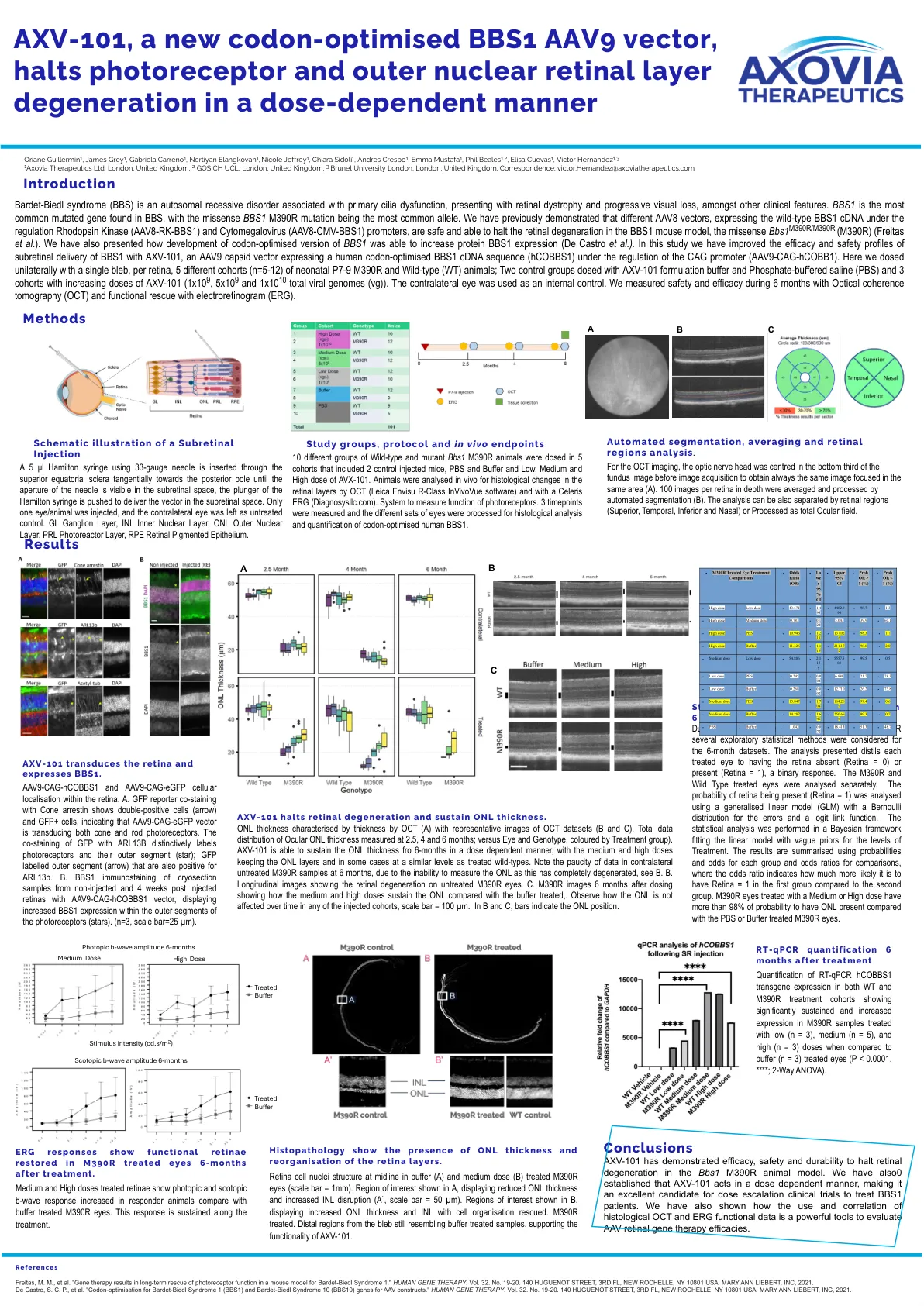
AXV-101,一种新的密码子优化的BBS1 AAV9向量,停止...
Bardet-Biedl综合征(BBS)是一种与原发性纤毛功能障碍相关的常染色体隐性疾病,表现出视网膜营养不良和进行性视觉丧失,以及其他临床特征。bbs1是在BBS中发现的最常见的突变基因,而错义BBS1 M390R突变是最常见的等位基因。我们先前已经证明,在调节的Remodopsin激酶(AAV8-RK-BBS1)和巨细胞病毒(AAV8-CMV-BBS1)下表达野生型BBS1 cDNA的不同AAV8载体是安全且能够停止BBS1 Missense Youse BBBS Mode bbs1鼠标BBS1 MISSONSE BBS1 MORTENS MISSENSE MOLTENS MISTENS MORTANE DENINALION的促进剂(AAV8-CMV-BBS1)的启动子(M390R)(Freitas等人)。我们还介绍了BBS1的密码子优化版本的开发如何增加蛋白BBS1表达(De Castro等人)。在这项研究中,我们通过AXV-101(在CAG启动子(AAV9-CAG-HCOBB1)调节下表达人类密码子优化的BBS1 cDNA序列(HCOBBS1)(AAV9-CAGBB1),我们提高了AXV-101的视网膜下递送的功效和安全概况。在这里,我们单方面用单一的泡沫给了新生儿P7-9 M390R和野生型(WT)动物的5种不同的队列(n = 5-12);用AXV-101配方缓冲液和磷酸盐缓冲盐水(PBS)和3个队列的两个对照组,以及增加剂量的AXV-101(1x10 9,5x10 9和1x10 10 10总病毒基因组(VG))。对侧眼被用作内部对照。我们使用光学相干断层扫描(OCT)和用电子图(ERG)的功能救援测量了6个月内的安全性和功效。
病内干扰素α-2b作为马周围鳞状细胞癌的新型治疗
鳞状细胞癌(SCC)和眼部SCC(PSCC)是局部侵袭性肿瘤,是马眼的最常见癌症[1]。眼睛或眼周SCC(PSCC)发展的风险因素包括缺乏眼周的皮肤色素沉着以及暴露于太阳辐射和紫外线光的高率[2,3]。纯种马,呼ring和草稿也表明,尽管具有足够的眼部色素沉着[2-5],SCC的患病率也增加了,并且在损伤特异性DNA结合蛋白2(DDB2)中的错义突变已被发现是Corneolimmbal和Third Epeeleelid ccc in hafling的原因,是Corneolimmbal和Third Epecc in hafling的原因。有多种用于治疗PSCC的治疗方式[3,4,8 - 13]。在某些情况下,具有适当边缘和相邻疗法的眼部SCC的手术切除可以治愈。 然而,由于眼周皮肤对潜在的筋膜和骨骼的紧密粘附,PSCC的手术管理提出了独特的挑战[14]。 此外,由于安全性和设备的可用性,辐射和光动力学治疗等其他治疗方法可能需要全身麻醉或转诊中心护理。 因此,对于PSCC的管理新方法仍然存在很大的未满足,尤其是那些可以在门诊环境中交付的方法。 免疫疗法现在是人类医学中肿瘤治疗的新型新方法,并依靠患者免疫系统的激活来消除肿瘤细胞。 还评估了肿瘤对IFNA2B治疗的临床相关性。具有适当边缘和相邻疗法的眼部SCC的手术切除可以治愈。然而,由于眼周皮肤对潜在的筋膜和骨骼的紧密粘附,PSCC的手术管理提出了独特的挑战[14]。此外,由于安全性和设备的可用性,辐射和光动力学治疗等其他治疗方法可能需要全身麻醉或转诊中心护理。因此,对于PSCC的管理新方法仍然存在很大的未满足,尤其是那些可以在门诊环境中交付的方法。免疫疗法现在是人类医学中肿瘤治疗的新型新方法,并依靠患者免疫系统的激活来消除肿瘤细胞。还评估了肿瘤对IFNA2B治疗的临床相关性。对于人类的SCC,干扰素α(IFNα)具有大量的研究,记录了其用作抗癌治疗[15]。提出的IFNα处理对SCC的作用机制包括肿瘤抑制基因的下调,主要组织相容性(MHC)1类分子的上调肿瘤表达,NK细胞的激活和抑制肿瘤血管生成[16]。许多出版物记录了使用IFNα来增强化学疗法在人头和颈部SCC治疗中的细胞毒性作用[17]。在一项研究中,干扰素α-2B(IFNα2B)成功用作人类患者的巨型眼表SCC的局部和周围注射治疗[18]。在本研究中,我们研究了使用人类重组IFNα2B作为马PSCC的新型治疗方法的安全性和潜在功效。次要的目的是评估已治疗的马匹的存在DDB2错义突变以及对人类重组IFNα2B的血清抗体的发展,并确定其对治疗结果的影响。我们假设,周围的IFNα2B会诱导具有最小副作用的治疗马匹的肿瘤消退,更大或更具侵入性的病变的反应较小,并且DDB遗传变体的纯合性和/或抗IFNα2B血清2B血清抗体与治疗反应相关。
使用 ACEofBASEs 靶标预测对具有碱基编辑的 DNA 变异进行精确的体内功能分析
摘要单核苷酸变异 (SNV) 是影响个体性状和疾病易感性的普遍遗传因素。碱基编辑器、橡胶和铅笔基因组编辑工具的最新开发和优化现在有望实现对模型生物中的 SNV 进行直接功能评估。然而,缺乏有助于靶标预测的生物信息学工具限制了碱基编辑在体内的应用。在这里,我们为青鳉 (Oryzias latipes) 和斑马鱼 (Danio rerio) 中的腺嘌呤和胞嘧啶碱基编辑提供了一个框架,非常适合可扩展的验证研究。我们开发了一个在线碱基编辑工具 ACEofBASEs(对碱基编辑的仔细评估),通过简化 sgRNA 设计和进行脱靶评估来促进决策。我们在青鳉和斑马鱼中使用最先进的腺嘌呤 (ABE) 和胞嘧啶碱基编辑器 (CBE) 来高效编辑眼色素沉着基因和转基因 GFP 功能。编码肌钙蛋白 T 和钾通道 ERG 的基因中的碱基编辑忠实地再现了已知的心脏表型。等位基因的深度测序揭示了预期编辑的丰富性,而 ABE8e 和 evoBE4max 的插入或删除 (indel) 事件水平较低。我们最终在 F0 和 F1 中验证了先天性心脏病 (CHD) dapk3、ube2b、usp44 和 ptpn11 的新候选基因中的错义突变,这些目标基因中有基因型-表型相关性。该碱基编辑框架适用于鱼类中可获得的多种 SNV 易感性状,有助于直接验证候选基因并确定其优先级,以便进行详细的机制下游研究。
针对无意义或罕见突变的新治疗方法
• 无义突变:它们在 DNA 序列的某个点(根据突变而变化)包含三个碱基(密码子),发出信号来中断 CFTR 蛋白的合成:它们也称为“停止”突变。由此产生的蛋白质被截断和去除•错义突变:导致 DNA 序列中碱基三联体交换的突变:这意味着在蛋白质链的某个点上,一个氨基酸被另一个氨基酸取代。这种替换不会去除蛋白质,但可以决定或多或少严重的功能改变,这取决于链的点和被替换的氨基酸的类型。在意大利,它们约占所有突变的 7%:最常见的(约 5%)是 N1303K。 • 移码突变:非常罕见(并且通常很难用当前技术识别),通过插入(添加)或删除(截断)大段 DNA 导致基因序列的重大改变,从而大大阻止 CFTR 蛋白的合成。在意大利,总体而言,它们所占比例不到 0.5%:例如 541delC 或 3667ins4(“del”或“ins”代表删除或插入)。 • 剪接突变:“剪接”是将基因的“编码”DNA 部分(称为“外显子”)中包含的遗传信息转移到信使 RNA 的机制,信使 RNA 负责控制蛋白质的合成。剪接机制受基因的“非编码”部分(称为“内含子”)的调控。与其他突变不同,剪接突变位于内含子中,而不是外显子中。这些突变会破坏代码的传输,通过或多或少地阻止正常 CFTR 蛋白的合成(具体取决于突变的类型):本质上,这些突变会导致一定比例的正常 CFTR 和一定比例的改变或缺失的 CFTR。患有这些突变的人的临床情况取决于在合成过程中保留了多少正常 CFTR
CAR介导的NK细胞的靶向克服了由ICAM-1下调引起的肿瘤免疫逃逸
抽象背景免疫检查点抑制剂(ICI)在癌症患者中的存活率大大提高,但通常伴随着严重的免疫相关不良事件(IRAE),这有时是不可逆的。胰岛素依赖性糖尿病是一种罕见但改变生命的IRAE。我们的目的是确定在发展为胰岛素依赖性糖尿病的患者中是否会观察到复发的体细胞或种系突变。我们对13例因ICI暴露而患有糖尿病的患者(ICI诱导的糖尿病,ICI-DM)进行了RNA和整个外显子组测序,与未患糖尿病的对照患者相比。导致ICI-DM患者的肿瘤,我们没有发现常规1型糖尿病自身抗原的表达差异,但是我们确实观察到ORM1,PLG和G6PC的显着过表达,所有这些都与1型糖尿病有关或与胰腺和胰岛细胞功能有关。有趣的是,我们观察到13例ICI-DM患者中9例肿瘤中NLRC5中的错义突变,而在对照患者中未观察到的患者对同一癌症的相同药物治疗。对ICI-DM患者的种系DNA进行了测序;所有NLRC5突变都是种系。NLRC5种系变体的患病率显着大于一般人群(P = 5.98×10 -6)。尽管NLRC5与1型糖尿病的发育有关,但在1型糖尿病患者的公共数据库中未发现种系NLRC5突变,这表明免疫治疗治疗的癌症患者中胰岛素依赖性糖尿病的机制不同。结论验证了NLRC5突变作为潜在的预测生物标志物,因为它可能会改善患者选择治疗方案的选择。此外,这种遗传改变表明在检查点抑制剂治疗的情况下,胰岛细胞破坏的潜在机制。
CSPP1,TMEM67,PLP1和GAN相关的突变...
背景和目标:神经系统疾病严重影响患者的心理,性格和运动功能,全球患病率上升,尤其是在低收入和中等收入的国家。这项研究旨在评估儿科神经系统疾病中的基因突变,使患者有助于我们对这些疾病的遗传基础的理解。方法:在当前的调查中,所有在2023年至2024年期间被转诊至神经病学部门的母体迹象的患者均已评估。使用Agilent Sureselect Human All Exon Kit V6富含来自患者的DNA样品,然后根据制造商的程序在Illumina HISEQ 4000平台上进行了测序。结果:在当前的横断面研究中,评估了13例母体神经系统疾病患者,包括6名男性(46%)和7个女性(54%)。我们的结果确定了遗传性神经系统疾病,包括乔伯特综合征,Pelizaeus-Merzbacher病和巨型轴突神经病1。我们的数据在PLP1基因的外显子8(NM_001128834.3:c.772a> c; p.met258leu)中鉴定出了一个新的错义突变,并在患有pelizaeus-merzbacher病的患者中具有X连锁的隐性遗传。基因变体,包括外显子20(NM_001382391.1:c.2259_2260delaa; P.Glu7555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555GLYFSTER30)和常染色体隐性膜体固体TMEM67在Exon 8(Exon 8(NM_1537)中> C.725)在乔伯特综合征患者中检测到p.asn242ser)。最后,在患有巨大轴突神经病1的患者中,检测到纯合gan突变(NM_022041.4:c.1177t> c; p.cys393arg)。结论:我们的发现对于理解神经系统疾病的病理生理可能很有用。此外,这项研究还表明了遗传分析在使用神经系统疾病患者中使用治疗策略的重要性。
带有交叉...
肿瘤异质性是胶质母细胞瘤(GBM)治疗衰竭和肿瘤复发的关键原因。我们的嵌合抗原受体(CAR)T细胞(2173 CAR T细胞)临床试验(NCT02209376)针对表皮生长因子受体(EGFR)变体III(EGFRVIII)的临床试验(EGFRVIII)成功地将T细胞跨GBM活性肿瘤部位脑屏障T细胞成功地传递。然而,插入的汽车T细胞仅与EGFRVIII+肿瘤的选择性丧失有关,对EGFRVIII-肿瘤细胞几乎没有影响。car t处理后的肿瘤标本显示EGFR扩增和致癌EGFR EGFR外细胞外域(ECD)错义突变,尽管EGFRVIII丧失。为了解决肿瘤逃生,我们通过将单克隆抗体(MAB)806与4-1BB共刺激结构域融合来产生EGFR特异性汽车。使用体外和体内模型将所得构建体与GBM中的2173个CAR T细胞进行了比较。806个CAR T细胞特异性裂解的肿瘤细胞和分泌的细胞因子响应于U87MG细胞,GBM神经圈衍生的细胞中的EGFR,EGFRVIII和EGFR-ECD突变,响应于扩增的EGFR,EGFRVIII和EGFR-ECD突变。806 CAR T细胞并不含有重要程度的胎儿脑星形胶质细胞或原发性角质形成细胞。与2173个CAR T细胞相比,它们在体内也表现出优质的抗肿瘤活性。806个CAR T细胞对EGFR改变的广泛特异性使我们有可能在肿瘤内靶向多个克隆,并通过抗原丧失减少肿瘤逃生的机会。
肾集合管癌治疗中的治疗挑战:病例报告及文献综述
摘要 肾集合管癌 (CDC) 是一种罕见的肾细胞癌。它是一种恶性肿瘤,预后不良,治疗选择有限。一名 67 岁的男性,在因血尿、食欲不振和体重减轻以及腰痛接受评估时,发现左肾肿块伴有肺和骨转移。他接受了左肾根治性切除术,组织病理学检查证实了 CDC。他接受了卡铂和吉西他滨的姑息化疗。三个周期后的计算机断层扫描 (CT) 扫描显示部分反应。五个周期后,由于肾功能恶化,化疗停止。对程序性细胞死亡配体 1 (PDL1) SP263 和 Her2 neu 进行的免疫组织化学研究结果为阴性。对 75 个可治疗基因组进行的下一代测序显示神经纤维瘤病 1 型 (NF1) 基因的功能丧失突变。据报道,涉及血小板衍生的生长因子受体 α 基因 (PDGFRA)、FAT 非典型钙粘蛋白 1 (FAT1) 和雄激素受体 (AR) 基因的错义突变是意义不明的变异。液体活检未检测到有临床意义的改变。因此,他开始服用舒尼替尼。2 个月后,他出现脑转移,接受全脑放射治疗。全身治疗改为单药 Nab-紫杉醇。三个周期后,他的前臂出现皮肤转移,化疗改为单药阿霉素。三个周期的阿霉素治疗后,他死于该疾病。诊断后他存活了 16 个月。转移性 CDC 的一线治疗是吉西他滨和顺铂化疗。尚无确定的二线治疗方法。在这个时代,针对可靶向基因改变的下一代测序可以帮助我们选择后续治疗方法。