XiaoMi-AI文件搜索系统
World File Search System血液学护理中的挑战:镰状细胞疾病和多发性骨髓瘤并发的病例报告
此病例报告详细介绍了一名具有多方面病史的69岁非裔美国女性的复杂医疗旅程,包括患有血红蛋白C疾病的镰状细胞贫血,甲状腺功能减退症,高胆固醇,严重肥胖,自身免疫性溶血性贫血和多发性骨髓瘤。最初转诊用于评估无症状全周期症,后来被诊断出患有IgG Kappa单克隆性蛋白血症,与多发性骨髓瘤一致,ISS II II期。在整个治疗过程中,她都接受了多种化学疗法的周期,面临多种并发症,例如复发性的镰状细胞危机,明显的贫血和肝酶升高。这些并发症需要仔细管理和对她的治疗方案进行调整,这反映了她共处的条件之间的复杂相互作用。尽管面临这些挑战,但患者仍表现出部分改善,强调了对管理此类复杂病例的量身定制和多学科方法的需求。本报告强调了治疗并发性镰状细胞疾病和多发性骨髓瘤患者的诊断和治疗困难,强调了个性化护理以优化结果的重要性。
文章I这个网络的名称是:全球血液和骨髓移植网络(WBMT)WBMT的第一次会议是在MA
第三条Mission WBMT通过使用协调,交流和倡导的统治,通过协作来促进干细胞移植(SCT),干细胞捐赠,蜂窝疗法(CT)和认证以及在全球范围内获得SCT的卓越。这种合作的目的是专门从事慈善,科学和教育活动和努力,包括具体但不限于促进和促进许多科学和临床学科的促进和促进,以及与SCT和CT有关的信息和思想的交流和扩散,并鼓励有关这些问题的调查。该网络的重点是协作促进SCT和CT领域,同时不避免其成员社会的活动。
计费摘要骨髓/干细胞移植
ProviderPublic.mybcbswny.com Wellpoint Partnership,LLC为Highmark Blue Cross Blue Shield的托管Medicaid提供管理服务。Highmark Western and New York Inc. D/B/A Highmark Blue Cross Blue Shield是Blue Cross Blue Shield协会的独立持有人。NYHM-CD-058107-24 | 2024年10月
同种异性骨髓 - 衍生的间充质基质细胞...
抽象的风湿病学家和风湿病学在单张教疼痛的概念化中起着重要作用,因为典型的Nociplastic疼痛条件是纤维肌痛。纤维肌痛以前被称为纤维炎,直到由于缺乏全身性炎症和组织损伤而显然可以与自身免疫性疾病区分开。单张教疼痛现在被认为是伤害性疼痛(由于周围损伤或炎症引起的疼痛)和神经性疼痛外,还被认为是疼痛的第三个描述剂/机制。单张教疼痛可以孤立地发生,也可以与其他疼痛机制合并,因为自身免疫性疾病的个体通常发生。我们现在知道,鼻骨疼痛的基本症状是普遍的疼痛(或者在没有炎症/损害迹象的区域疼痛),伴随着疲劳,睡眠和记忆问题。有客观的证据表明疼痛的扩增/增强以及非疼痛的刺激,例如灯光的亮度以及声音或气味的不愉快性。单张教疼痛状态可以由创伤,感染和慢性应激源等多种压力触发。这些特征共同表明,中枢神经系统(CNS)在引起和维持鼻骨疼痛方面发挥了重要作用,但是这些CNS因素可能是由持续的外周伤害感受器输入驱动的。最有效的致命药物疗法是非阿片类药物造成镇痛药,例如三轮车,5-羟色胺 - 氯肾上腺素再摄取抑制剂和gabapentinoids。但是,鼻骨疼痛治疗的支柱是使用多种非药理综合疗法,尤其是那些改善活动/运动,睡眠和解决心理学合并症的疗法。
假设骨髓的血管内皮周围的造血性干细胞层中吸收剂量的评估
表4-1用PHITS模型计算出的137 C的血管周围HSC层,并与使用SAF和转移系数估算的ICRP60和ICRP103
二甲双胍调节骨髓基质细胞在糖尿病小鼠中加速骨骼愈合
抽象映射神经递质身份对神经元是理解神经系统中信息流的关键。它还为研究神经元身份特征的发展和可塑性提供了宝贵的入口点。在秀丽隐杆线虫神经系统中,神经纤维 - 米特的身份在很大程度上是通过编码神经递质生物合成酶或转运蛋白的神经递质途径基因的表达模式分析来分配的。但是,其中许多作业都依赖于可能缺乏相关顺式调节信息的多拷贝记者转基因,因此可能无法提供神经递质使用情况的准确图片。我们分析了秀丽隐杆线虫中所有主要类型的神经递质(谷氨酸,乙酰胆碱,GABA,5-羟色胺,多巴胺,多巴胺,酪胺和章鱼胺)中所有主要类型的神经递质的16个CRIS/CAS9工程敲入报告菌株的表达模式。我们的分析揭示了这些神经递质系统在神经元和神经胶质中以及非神经细胞中的新颖位点,最著名的是在性腺细胞中。所得表达的地图集定义了可能仅是神经肽的神经元,它基本上扩展了能够共同传播多个神经递质的神经元的曲目,并鉴定了单胺能神经植物的新颖位点。此外,我们还观察到单胺能合成途径基因的异常共表达模式,这表明存在新型单胺能发射器。我们的分析导致迄今为止,神经递质使用量最广泛的全动物范围图构成了最广泛的全动物范围图,为更好地理解秀丽隐杆线虫中神经元通信和神经元身份规范铺平了道路。
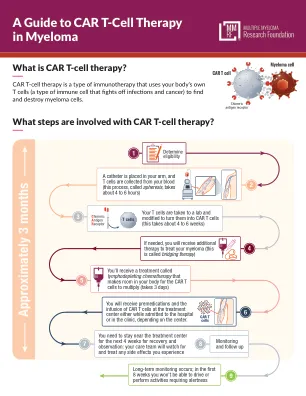
了解骨髓瘤
致谢 所有更新内容均由 Westmead 医院和悉尼基督复临安息日会医院的血液病学家 Ian Bilmon 博士进行临床审核。 此版本以上一版为基础,并由以下专家小组审核:Ian Bilmon 博士(见上文);消费者 Martin Boling;澳大利亚骨髓瘤协会骨髓瘤专科护士 Catherine Bowley;Calvary Mater Newcastle 放射肿瘤学家 Samuel Dickson 博士;威尔士亲王医院血液科临床护理顾问 Rachelle Frith;Calvary Mater Newcastle 血液病学家 Wojt Janowski 博士;新南威尔士州癌症委员会 13 11 20 顾问 Yvonne King。 我们要感谢所有参与本书当前和过去版本修订的医疗专业人士、消费者和编辑团队。 读者须知 对于影响您健康的问题,请务必咨询您的医生。本手册旨在作为该主题的一般介绍,不能被视为医疗、法律或财务建议的替代品。您应该从适当的专业人士处获取与您的具体情况相关的独立建议,并且您可能希望与他们讨论本手册中提出的问题。
骨髓移植受者的CMV重新激活和感染的治疗
letermovir -BlueTeq所需。................................................................................................ 4 Valganciclovir ........................................................................................................................ 5 Ganciclovir ............................................................................................................................. 7 Foscarnet Sodium (off-label) .................................................................................................. 8 Cidofovir (off-label) - Micro approval required.......................................................................10 Maribavir- Blueteq required.需要微观批准。...........................................................12
同种异体和自体血液和骨髓中乙型肝炎和丙型肝炎的治疗
未检测到 HBV DNA – 允许捐献以进行挽救生命的移植。检测到 HBV DNA – 禁忌捐献 HBsAg 阴性、抗 HBc 阳性和抗 HBs > 100 IU/L – 允许捐献 丙型肝炎抗体阳性 – 相对禁忌捐献。检查 HCV RNA – 确认 HCV RNA 检测表明当前感染。现在可以使用有效的抗病毒疗法,从而对 HCV 产生持续的病毒学反应。潜在捐献者的 HCV 感染并不等于绝对禁忌捐献用于挽救生命的移植材料,但是必须考虑移植的净收益与不接受特定移植的风险。这种风险/收益分析允许将 HCV 感染的供体移植给未感染的接受者。接受者/自体患者结果 2 HBsAg 阳性