XiaoMi-AI文件搜索系统
World File Search System黄嘌呤氧化酶,微生物
[3]。fatokun AA等。过氧化氢在小脑颗粒神经元培养物中介导黄嘌呤和黄嘌呤氧化酶的损伤。Neurosci Lett。2007年4月6日; 416(1):34-8。
黄嘌呤氧化酶抑制剂戒断综合征的证据
尿酸是人类三磷酸腺苷(ATP)代谢的最终产物,受到黄嘌呤氧化酶(XO)的影响。XO抑制剂(XOI)抑制了尿酸的产生,并可能储存ATP(Kuwabara等,2023)。XOI中断显示了XOI戒断综合征,其ATP耗竭并增加了死亡率(Johnson等,2019; Ghang等,2020)。痛风和心血管病患者的Febosostat和别嘌呤醇的心血管安全性(CARES)试验表明,与别嘌醇相比,Febosostat使用的使用与心血管相关的死亡增加有关(White等人,2018年,2018年)。然而,护理表明,在受试者不接受治疗时,近85%的死亡发生(Bubb,2019年)。护理亚分析发现,在中断Febosostat或adlopurinol后,在初始阶段增加了重大不良心血管事件(MACE)和心血管死亡经文事件(Ghang等,2022)。FDA显示了FeBoxostat的黑盒警告(Abeles and Pillinger,2019年),但Febosostat vers andlopurinol简化试验(FAST)的辍学率较低,没有发现两组之间的心血管血管成果或死亡的群体差异(Mackenzie等人(Mackenzie et al。,2020年)。这些结果表明,无论使用的XOI类型如何,MACE或死亡的主要原因与XOI的撤离有关。我们假设死亡的主要原因是从XOI撤离的原因是消除XOI的有益效应,例如减少尿酸,减少活性氧(ROS)和膨胀或储存ATP(Feig等,2008; Johnson等,2019)。这项研究检验了我们的假设,即口服XOI给药可提高死亡率,但停止导致死亡过多。这项研究分析了急性冠状动脉综合征(ACS)或心力衰竭患者(高危人群)的住院数据,以比较有或没有XOI和XOI持续和停职的死亡率。这项调查旨在阐明XOI给药的潜在利益以及与该脆弱人群中停用相关的风险。
1-甲基黄嘌呤可增强记忆和神经递质水平
1-甲基黄嘌呤(1-MX)是咖啡因和帕拉辛黄酮的主要代谢产物,可能有助于其活性。1-MX是一种腺苷受体拮抗剂,可提高神经递质的释放和存活能力。但是,尚无研究涉及1-MX摄入的潜在生理影响。与对照相比,这项研究的目的是比较1-MX对大鼠的记忆和相关生物标志物的影响。记忆(莫里斯水迷宫测试中的逃生潜伏期),神经递质(乙酰胆碱,多巴胺,γ-氨基丁酸(GABA))和神经化学物质(BDNF,Ceatalase,Gitalase,Glutathione,glutathione,glutathione,amyloid beta和amyloid beta和comclic gmp)是分析的(整个湿度)。 (16个月大的)大鼠补充了12天(1-mx的100 mg/d HED [UPLEVEL®,Ingenious Ingrediate L.P.,Lewisville,TX,USA])。1-MX的培养在年轻动物中降低了39%的逃生潜伏期,而老年动物的逃逸潜伏期则减少了27%(p <0.001)。此外,1-MX增加了乙酰基胆管,多巴胺,GABA和环状GMP的水平(全p <0.001)。此外,补充1-MX导致淀粉样蛋白β和更高的过氧化氢酶,BDNF和谷胱甘肽浓度降低(P <0.001)。总体而言,我们的发现表明1-MX可能具有认知增强和神经保护特性。
针对酶的活性位点的黄嘌呤氧化酶的新型可逆抑制剂
摘要:黄嘌呤氧化酶(XO)是一种氟蛋白蛋白,可将低黄嘌呤氧化为黄嘌呤,然后再催化尿酸,同时产生反应性氧。XO的功能改变可能导致严重的病理疾病,包括引起痛风的高尿酸血症和组织的氧化损伤。这些发现促使研究旨在针对这种关键酶的活性。在一项虚拟筛查研究的过程中,旨在发现针对另一种氧化还原酶超氧化物歧化酶的新型抑制剂,我们鉴定了四种具有非纯碱结构的化合物,即ALS -1,-1,-8,-15和-28,能够直接抑制XO。其抑制作用机制的动力学研究允许将这些化合物定义为XO的竞争抑制剂。最有效的分子是ALS-28(K I 2.7±1.5 µm),其次是ALS-8(K I 4.5±1.5 µm),而有效的ALS-15(K I 23±9 µm)和ALS-1(K I 41±14 µm)。对接研究阐明了ALS-28的抑制活性的分子基础,这阻碍了酶腔通道的底物与动力学研究中观察到的竞争机制一致地进入底物。此外,从ALS -8,-15和-1的停靠姿势中出现的结构特征可能解释了相对于ALS -28的较低抑制能力。所有这些结构无关的化合物代表了有价值的候选物,以进一步阐述有希望的铅化合物。
Linagliptin,一种基于黄嘌呤的二肽基肽酶-4抑制剂,可以改善实验性自身免疫性心肌炎
(a)实验性自身免疫性心肌炎(EAM)实验设计的示意图。BALB/c小鼠在第0天和第7天,在第0天和第7天,在第0天和第7天,皮下向乳腺蛋白重链肽乳液注射 - 乳胶链肽。小鼠
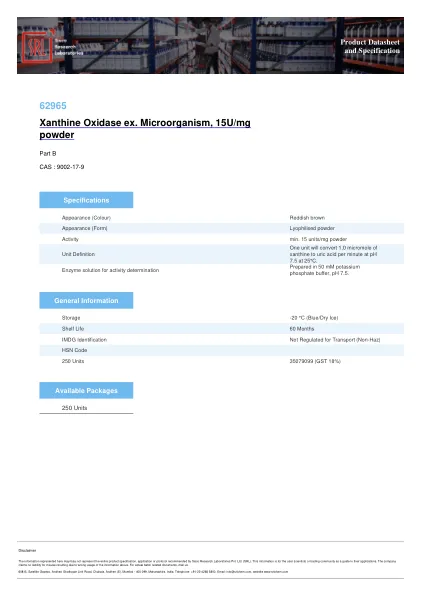
黄嘌呤氧化酶Ex。微生物,15U/mg粉末62965SISCO目录2024-25 SRL
您会在世界各地的6个不同地区和100多个国家 /地区找到该品牌。我们的主要动机一直是为世界各个角落的客户提供我们的产品,无论在任何地方或一个机构都在努力通过研究,创新,质量控制和制造来改善我们的生活质量。拥有40多个授权的代理商和分销商以及100多个贸易伙伴,总是在寻找与目标相似的公司建立更明亮,更持久的合作伙伴关系,即成为他们业务中最好的。在我们任命贸易伙伴之前,我们要进行系统的检查,以确保我们的合作伙伴可以为选择产品的尊贵客户提供更好的销售支持和售后服务。我们欢迎新的伙伴关系增长和繁荣。
黄嘌呤氧化酶Ex。微生物,15U/mg粉末62965 SISCO目录2024-25 SRL
此处代表的信息可能/可能不代表Sisco Research Laboratories Pvt建议的整个产品规范,应用或协议。ltd.(SRL)。此信息适用于用户科学家或贸易社区作为其应用程序的指南。该公司声称由于上述信息的错误使用而导致滥用的责任。对于实际相关文档,请邮寄我们。
Mocos 基因缺失导致小鼠发生黄嘌呤尿症、阻塞性肾病和主要代谢紊乱
摘要:背景:II 型黄嘌呤尿症是一种罕见的常染色体嘌呤疾病。这种隐性嘌呤代谢缺陷仍是一种未被充分认识的疾病。方法:我们培育出钼辅因子硫化酶 (Mocos) 基因被靶向破坏的小鼠,以便全面了解嘌呤疾病,并评估这种基因的病理生理功能,该基因存在于大量通路中,并且已知与自闭症有关。结果:缺乏 Mocos 的小鼠在 4 周龄内死于明显的阻塞性肾病肾衰竭,表现为黄嘌呤尿、黄嘌呤沉积、囊性小管扩张、Tamm Horsfall(尿调节蛋白)沉积、中性粒细胞坏死和偶尔出现的肾积水和尿石症。阻塞性肾病与中度间质炎症和纤维化反应、贫血、解毒系统减弱以及嘌呤、氨基酸和磷脂代谢的重大改变有关。相反,表达减少的 MOCOS 蛋白的杂合小鼠是健康的,没有明显的病理。结论:缺乏 Mocos 的小鼠会患上致命的阻塞性肾病,并伴有深刻的代谢变化。研究 MOCOS 功能可能为黄嘌呤尿症和其他需要早期诊断的疾病的潜在发病机制提供重要线索
胰岛素抵抗在健康体检者血浆黄嘌呤氧化还原酶激活中的可能作用
我们之前在一项横断面研究中发现胰岛素抵抗 (IR) 与血浆黄嘌呤氧化还原酶 (XOR) 活性相关。然而,IR 是否会诱导 XOR 活性增加尚未阐明。这项回顾性纵向观察研究包括 347 名参与者(173 名男性,174 名女性),他们每年接受健康检查并且未接受过药物治疗。在基线时确定了稳态模型评估 IR (HOMA-IR) 指数以及身体和实验室测量值。在基线和 12 个月的随访检查中,使用我们基于 [ 13 C 2 , 15 N 2 ] 黄嘌呤和液相色谱/三重四极杆质谱的新型检测方法测定血浆 XOR 活性。 IR 受试者(定义为 HOMA-IR 指数 ≥ 1.7(n = 92))的血浆 XOR 活性水平显著(p < 0.001)高于无 IR 的受试者(n = 255),12 个月后,180 人(51.9%)的血浆 XOR 活性增加。多变量线性和逻辑回归分析表明,基线时的 IR(而不是 BMI 或腰围)与血浆 XOR 活性显著相关(β = 0.094,p = 0.033),并且经过调整各种临床参数(包括基线时的血浆 XOR 活性)后,12 个月期间血浆 XOR 活性增加(比值比,1.986;95% 置信区间,1.048–3.761;p = 0.035)。这些结果表明,IR 以与肥胖无关的方式诱导血浆 XOR 活性增加。
[3H] 1,3-二溴酰基-8- ...
摘要1,3-二吡基-8-苯基黄嘌呤的胺官能化衍生物已以tri的形式制备,作为黄嘌呤胺(pH] XAC),用作用于腺苷受体的抗吸虫辐射。[3H] XAC具有较高的受体亲和力,较高的特异性活性,较低的非特异性膜结合,并且比1,3-二乙基-8-- [3H]苯甲胺更有利的亲水性,这是一种用于腺苷受体受体结合的黄嘌呤。在大鼠脑皮质膜中,[3H] XAC表现出可饱和的特异性结合,Kd为1.23 nm和A BM。在370c时为580 FMOL/mg的蛋白质。N6-(R-苯基丙酰丙基)腺苷是[3H] XAC结合的更有效的抑制剂,而不是5'-N-乙基辅助辅助腺苷,表明结合与Al-腺苷受体有关。在没有GTP的情况下,腺苷激动剂与[3H] XAC结合的抑制曲线是双相的,表明[3H] XAC与Al受体的低亲和力激动剂结合。在GTP存在下,腺苷类似物表现出[3H] XAC的结合的单相,低亲和力抑制。抑制[茶碱或各种8-苯基黄嘌呤的3HJXAC结合是单相的,并且这些效力与这些红明因作为腺苷受体拮抗剂的效力均具有均匀的效果。小牛脑膜中的受体部位对[3H] XAC表现出较高的亲和力(KD = 0.17 nm),而豚鼠中的部位表现出较低的富裕感(KD = 3.0 nm)。[3H] XAC结合位点的密度在所有物种的脑膜中相似。









![[3H] 1,3-二溴酰基-8- ...](/simg/f\fd051054b55479a6833f666a9c9b6a7d256b37ee.webp)