XiaoMi-AI文件搜索系统
World File Search System可卡因、苯二氮类药物和加巴喷丁类药物
来源:scotland.shinyapps.io/phs-drugs-radar-dashboard。数据来源:苏格兰救护服务处、PHS、苏格兰警察局、苏格兰国家档案馆
3HP 是两种药物的组合,利福喷丁和异烟肼,...
有力证据表明,治疗结核病感染(使用异烟肼或利福平单药治疗,或与其他药物联合使用)可有效预防成人和儿童进展为活动性疾病。据估计,2017 年新增结核病 (TB) 病例 1000 万,约 160 万人死于结核病。世界卫生组织 (WHO) 已制定雄心勃勃的目标,在未来 10-20 年内降低结核病发病率和死亡率,目标是到 2035 年消除结核病。然而,在考虑消除结核病之前,必须先讨论潜伏性结核病感染 (LTBI)、其诊断和治疗。据估计,有 17 亿人患有 LTBI,并且在其一生中面临患上结核病的风险。
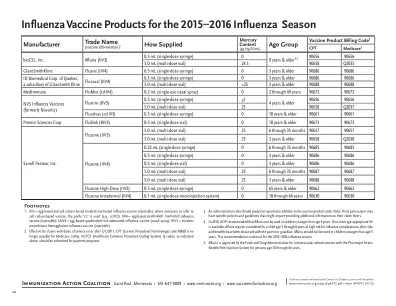
2015-2016 年流感季节的流感疫苗产品
脚注 1. IIV3 = 鸡胚和细胞培养三价灭活流感疫苗(注射剂);如需指代细胞培养疫苗,则使用前缀“cc”(例如 ccIIV3)。IIV4 = 鸡胚四价灭活流感疫苗(注射剂);LAIV4 = 鸡胚四价减毒活流感疫苗(鼻喷剂);RIV3 = 三价重组血凝素流感疫苗(注射剂)。 2. 自 2011 年 1 月 1 日或之后的服务申请起,CPT(现行程序术语)代码 90658 不再适用于 Medicare 支付;相反,应提交上述 HCPCS(医疗保健通用程序编码系统)Q 代码以进行支付。
用于鼻整形手术图像模拟的人工智能工具
摘要 在鼻整形术咨询期间,外科医生通常会创建预期结果的计算机模拟。人工智能模型 (AIM) 可以学习外科医生的风格和标准并自动生成模拟。本研究的目的是确定 AIM 是否能够模仿外科医生的标准来生成美容鼻整形手术的模拟图像。这是一项在 2019 年 11 月的鼻整形术会议期间对耳鼻喉科住院医生和专科医生进行的横断面调查研究。随机显示由外科医生和 AIM 创建的鼻整形术模拟的连续图像。参与者使用七点李克特量表来评估他们对所展示的模拟图像的同意程度,其中 1 表示完全不同意,7 表示完全同意。122 名医生中有 97 名同意参加调查。参与者和外科医生之间的平均一致性水平为 6(四分位距或 IQR 5 – 7);参与者和 AIM 之间的平均一致性水平为 5(IQR 4 – 6),p 值 < 0.0001。68.4% 的时间(95% 置信区间或 CI 64.9 – 71.7),评估人员完全或部分同意 AIM 的模拟结果。77.3% 的时间(95% CI 74.2 – 80.3),他们完全或部分同意外科医生的模拟结果。AIM 可以模拟外科医生的审美标准,生成计算机模拟的鼻整形图像。这可以让患者在面对面咨询之前对鼻整形术的可能结果有一个真实的近似值。该研究的证据级别为 4。
活着的毒力减弱的鼻免疫的随机对照试验
资金:由Bill和Melinda Gates Foundation(OPP1117728)和医学研究委员会奖(MR/M011569/1和MR/N016874/1)资助。JSB,RH,CMW和ERS在UCLH/UCL工作,该公司从卫生部的NIHR生物医学研究中心的资金计划中获得了资金。RSH是NIHR高级调查员。
鼻流感疫苗可能有助于减少A组的病例
流感是由病毒引起的常见和传染病。它比感冒更严重。儿童的鼻喷雾流感疫苗是安全,有效的,每年都会向儿童提供保护他们免受流感的影响。它完全无痛,并减少了感染向其他儿童和成人的传播。它将保护您的孩子,并防止他们因流感而生病,并需要休假或托儿所。即使健康的孩子也会因流感而严重患病。在某些情况下,流感会导致并发症。这些可以包括支气管炎,肺炎,疼痛的中耳感染,呕吐和腹泻。
Fluenz Tetra,Inn-Influenza疫苗(鼻腔衰减,鼻)
与细胞和包装制造商进行互动,因此他们的组装过程旨在有效地分离原材料,需要在行业层面上清算房屋,以吸收制造单元格时的额外成本(需要对该过程进行补充,而不是设计以进行成本和制造性,单元和包装制造商的成本和包装制造商的成本,生产能力,制造性,制造能力,制造能力 - 套装,以供您使用。对于回收玩家来说,这一额外的成本将是较低的成本,但是在下游只有6 - 7年,直到电池库存增加足够的体积为止;因此,这个交货时间需要通过一个清理房屋来满足。
青少年疫苗接种计划:中学简介
对于那些担心流感疫苗会导致 A 组链球菌感染的家长,我该说什么呢?感染流感和其他病毒会增加接下来几周内侵袭性 A 组链球菌感染的风险。侵袭性 A 组链球菌感染在 2009 年至 2010 年流感大流行期间有所增加。流感疫苗可降低同时感染流感和 A 组链球菌的风险,因此可降低患侵袭性 A 组链球菌的几率。我们强烈建议符合条件的儿童接种流感疫苗 - 这是保护他们免受严重疾病的最佳方法。儿童流感疫苗具有出色的安全记录,其中包括给学龄儿童和学龄前儿童使用的鼻喷剂,英国和全世界已有数百万儿童接种过这种疫苗。
iNCOVACC®,世界上第一个获得...认证的鼻内疫苗
海得拉巴,2022 年 11 月 28 日:疫苗创新和传染病疫苗开发商全球领导者 Bharat Biotech International Limited (BBIL) 今天宣布,iNCOVACC® (BBV154) 已获得印度中央药品标准控制组织 (CDSCO) 批准,可在紧急情况下限制使用,供 18 岁及以上人群使用,用于异源加强剂量。iNCOVACC® 是一种重组复制缺陷型腺病毒载体疫苗,具有预融合稳定化的 SARS-CoV-2 刺突蛋白。该候选疫苗已在 I、II 和 III 期临床试验中进行了评估,并获得了成功的结果。iNCOVACC® 经过特殊配制,可通过滴鼻剂进行鼻内给药。鼻腔给药系统的设计和开发旨在在中低收入国家实现成本效益。 iNCOVACC® 是与华盛顿大学圣路易斯分校合作开发的,该校设计并开发了重组腺病毒载体构建体,并在临床前研究中评估了其功效。与临床前安全性评估、大规模生产规模扩大、配方和给药装置开发(包括人体临床试验)相关的产品开发由 Bharat Biotech 进行。产品开发和临床试验部分由印度政府通过生物技术部 COVID Suraksha 计划资助。
鼻内mRNA-LNP疫苗接种可保护仓鼠免受...
预印本(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此版本的版权持有人于2023年1月12日发布。 https://doi.org/10.1101/2023.01.11.523616 doi:biorxiv Preprint