XiaoMi-AI文件搜索系统
World File Search SystemDrosophila
利用长读测序对果蝇进行近染色体水平基因组组装
。CC-BY-NC-ND 4.0 国际许可,根据 提供(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。它是此预印本的版权持有者,此版本于 2020 年 1 月 2 日发布。;https://doi.org/10.1101/2020.01.02.892844 doi:bioRxiv 预印本
使用果蝇种系组织中的长阅读RNA-seq鉴定和定量可转座元件转录本
转座元件(TES)是重复的DNA序列,可能能够在整个基因组中移动。除了它们固有的诱变效果外,TE还可以通过捐赠其内在的调节序列(例如促进细胞基因的异位表达)来破坏附近基因。te转录不仅对于TE换位本身是必需的,而且还可以与Te-Gene Fusion转录本相关,在某些情况下也是普遍转录的产物。因此,正确确定了TE副本的转录状态,是为了理解TE在宿主基因组中的影响。识别和量化TE转录的方法主要依赖于简短的RNA-seq读取以在家庭级别估算TE表达,同时使用特定算法来区分副本特定的转录。但是,将简短的读数分配给其正确的基因组位置,基因组特征并不是微不足道的。在这里,我们检索了果蝇的全长cDNA(远程prime,词汇),并使用牛津纳米孔技术进行了对其进行验证。我们表明,可以使用长阅读RNA-Seq来识别和量化复制级别的转录TE。尤其是,使用长读数比简短读数更好地估计了插入过度插入的注释基因。尽管如此,长TE转录本(> 4.5 KB)并未得到很好的捕获。大多数表达的TE插入对应于失去其转置能力的副本,在家庭中,只有几份副本表示。长阅读测序还允许识别约107个TE副本的剪接转录本。总的来说,睾丸和卵巢之间TE的第一个比较在子类和插入水平上发现其转录景观中的差异。
跨学科研究:研究人员职业跨学科研究的动机和挑战
转座元素(TES)是寄生虫DNA序列,能够沿所有基因组的染色体移动和繁殖。可以通过靶向沉默表观遗传标记来控制它们,这可能会影响包括基因在内的相邻序列的Chro Matin结构。在这项研究中,我们使用了来自几个果蝇Melanogaster的卵巢样品和果蝇Simulans野生型菌株产生的转录组和表观基因组高吞吐量数据,以精细量化Te插入对基因RNA水平和组蛋白标记的影响(H3K9ME3和H3K9ME3和H3K4ME3)。我们的结果揭示了与梅拉·诺加斯特(D. Mela Nogaster)相比,TES对D. simulans中直源基因的表观遗传作用更强。同时,我们发现了D. mel Anogaster基因组中TE对基因H3K9me3的差异的较大贡献,这证明了Te数字周围的Te数与D. melanogaster中这种染色质标记的水平的更强相关性。总体而言,这项工作有助于理解TE在基因组中的物种特异性影响。它为TE提供的可观自然变异性提供了新的启示,这可能与适应性和进化潜力的对比有关。
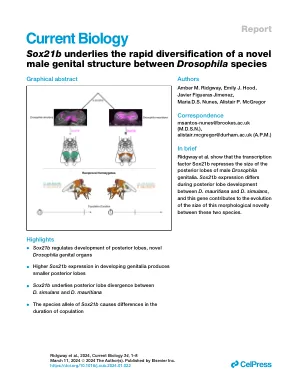
Sox21b是果蝇物种之间新型男性生殖器结构的快速多样化
然而,关于新结构演变的遗传基础和其多样化的机制的遗传基础知之甚少。雄性生殖器的膀胱后叶是特定果蝇物种的新颖性。10–13裂片抓住雌性的产卵剂,并在腹部ter骨之间插入,因此对于交配和物种识别很重要。10–12,14–17后叶可能是从后螺旋中心10的同事演变而来的,此后在D. Simulans crade中的形态学上已经分散,尤其是在过去的240,000年中,在过去的240,000年中,由性选择驱动。18–21这种多样化的遗传基础是多基因的,但据我们所知,尚未鉴定出一个病因基因。22–30确定这些次要性结构多样化的基因对于理解对交配和物种识别的进化影响至关重要。在这里,我们表明SOX21B负调节后叶大小。这与D. Mauritiana中的Sox21b表达扩展是一致的,D. Mauritiana的后叶比D. simulans更小。我们通过产生相互的半合子来测试这一点,并确认了Sox21b的变化后叶下叶的后叶的演化。更重要的是,我们发现后叶大小差异是由Sox21b的特异性等位基因引起的,显着影响交配持续时间。综上所述,我们的研究揭示了新型形态结构及其对共管行为的功能影响的性别驱动驱动的多样化的遗传基础。
评估1型糖尿病是果蝇模型中帕金森氏病的危险因素
Álvarez -Rendón,J。P.,Salceda,R。和Riesgo -Escovar,J。R.(2018)。果蝇黑色素果蛋白酶作为2型糖尿病的模型。Biomed Research International,2018,1 - 16。https://doi.org/10.1155/2018/1417528美国糖尿病协会。(2013)。糖尿病的诊断和分类。在糖尿病护理中,36(补充1),S67。https://doi.org/ 10.2337/dc13-S067 Anandhan,A.帕金森氏病的代谢功能障碍:生物能力,氧化还原稳态和中央碳代谢。大脑研究公告,133,12 - 30。(2017)。在发展中国家及其相关因素中增加糖尿病患病率。PLOS ONE,12(11),E0187670。https://doi.org/10.1371/journal.pone.0187670 Avazzadeh,S.,Baena,J.M.,Keighron,C.,Feller -Sanchez,Y。,&Quinlan,Y。,&Quinlan,L。R.(2021)。对帕金森氏病进行建模:IPSC,以更好地了解人类病理。脑科学,11(3),373。https://doi.org/10.3390/brainsci11030373 Balestrino,R。,&Schapira,A。H. V.(2020)。帕金森病。欧洲神经病学杂志,27(1),27 - 42。https://doi.org/10.1111/ene.14108 Broughton,S。J.,Piper,M。D. W.,Ikeya,Ikeya,Ikeya,Ikeya,Ikeya,T. L.(2005)。 科学进步,7(24),EABG4336。 https://doi.org/10。欧洲神经病学杂志,27(1),27 - 42。https://doi.org/10.1111/ene.14108 Broughton,S。J.,Piper,M。D. W.,Ikeya,Ikeya,Ikeya,Ikeya,Ikeya,T. L.(2005)。科学进步,7(24),EABG4336。https://doi.org/10。https://doi.org/10。寿命更长,代谢改变以及果蝇中的应激抗性,使细胞的消融产生像配体这样的胰岛素。美国国家科学院的会议记录,102(8),3105 - 3110。https://doi.org/10.1073/pnas.0405775102 Chatterjee,N。,&Perrimon,N。(2021)。是什么燃烧了苍蝇:果蝇中的能量代谢及其在肥胖和糖尿病研究中的应用。1126/sciadv.abg4336 Cheong,J。L. Y.,de Pablo -Fernandez,E。,Foltynie,T。,&Noyce,A。J. J.(2020)。2型糖尿病与Pparkinson氏病之间的关联。帕金森氏病杂志,10(3),775 - 789。https:// doi。org/10.3233/jpd-191900 Chomova,M。(2022)。朝着糖尿病大脑中分子相互作用的解密。生物医学,10(1),115。https://doi.org/10。3390/Biomedicines10010115 Church,F。C.(2021)。帕金森氏病的运动和非运动症状的治疗选择。生物分子,11(4),612。https:// doi.org/10.3390/biom11040612 de Iuliis,A.,Montinaro,E.,Fatati,G.,G.糖尿病和帕金森氏病:胰岛素和多巴胺之间的危险联络。神经再生研究,17(3),523 - 533。https://doi.org/10.4103/1673-5374.320965
果蝇幼虫大脑中高度不稳定的mRNA编码了动态调节的转录因子
每种 RNA 的水平取决于其产生率和衰变率之间的平衡。尽管先前的研究已经测量了组织培养和单细胞生物中整个基因组的 RNA 衰变,但很少有实验是在完整的复杂组织和器官中进行的。因此,尚不清楚在培养细胞中发现的 RNA 衰变决定因素是否在完整组织中保留,以及它们在邻近细胞类型之间是否不同以及在发育过程中是否受到调节。为了解决这些问题,我们通过使用 4-硫尿苷对整个培养的果蝇幼虫大脑进行代谢标记,测量了全基因组的 RNA 合成和衰变率。我们的分析表明,衰变率范围超过 100 倍,并且 RNA 稳定性与基因功能有关,编码转录因子的 mRNA 比参与核心代谢功能的 mRNA 稳定性低得多。令人惊讶的是,在转录因子 mRNA 中,更广泛使用的转录因子与在发育过程中仅短暂表达的转录因子之间存在明显的界限。编码瞬时转录因子的 mRNA 是大脑中最不稳定的。这些 mRNA 的特点是大多数细胞类型中的表观遗传沉默,如其富含组蛋白修饰 H3K27me3 所示。我们的数据表明存在针对这些瞬时表达的转录因子的 mRNA 不稳定机制,从而可以快速高精度地调节它们的水平。我们的研究还展示了一种测量完整器官或组织中 mRNA 转录和衰减率的通用方法,为了解 mRNA 稳定性在调节复杂发育程序中的作用提供了见解。
flyrnai.org - 果蝇RNAi筛查中心和转基因RNAi项目的数据库:2021 Update
果蝇RNAi筛查中心和转基因RNAi项目(DRSC / TRIP)的Flyrnai数据库提供了一系列在线资源,可促进功能基因组学研究,并特别强调果蝇Melanogast。目前,数据库提供:以基因为中心的源,可促进直系同源映射和刻度有关通用基因模型物种中直系同源物的信息;以试剂为中心的资源,可帮助研究人员识别RNAi和CRISPR SGRNA试剂或设计;以及以数据为中心的资源,以促进转录数据的可视化和挖掘,蛋白质修饰数据,蛋白质间相互作用等。在这里,我们讨论了有助于生物学和生物医学搜索者有效识别,可视化,分析和整合果蝇和其他物种的信息和数据的更新和新功能。,这些资源共同促进了功能基因组学的多个步骤,从构建基因和试剂列表到数据的管理,分析和集成。
自噬依赖的丝状伪足动力学限制了果蝇大脑连接过程中突触伙伴的选择
大脑连接非常精确,但大多数神经元一旦有机会就会与错误的伙伴形成突触。动态轴突-树突定位可以限制突触形成相遇,但发育中的大脑中时空相互作用动力学及其调节仍然基本未知。在这里,我们表明轴突伪足的动力学限制了突触形成和伙伴选择,而这些神经元原本不会被阻止形成错误的突触。利用 4D 成像技术对发育中的果蝇大脑进行研究,我们发现伪足动力学受自噬调控,自噬是一种普遍的降解机制,其在大脑发育中的作用仍不太清楚。自噬体以令人惊讶的特殊性在突触形成伪足中形成,随后伪足崩塌。计算建模和遗传实验表明,突触构建材料的自噬降解改变定量调节突触形成。伪足稳定性的增加导致错误的突触伙伴关系。因此,自噬通过动力学排除过程来限制不适当的伴侣选择,这对于连接特异性至关重要。
赤拟谷盗和黑腹果蝇的直系同源基因
研究 [12–15],这使得拟谷盗成为比较遗传学、分子生物学、进化和发育等不同生物过程的绝佳模型 [2, 10, 11]。鉴于果蝇的衍生生物学,拟谷盗也
果蝇中的定量,全基因组分析揭示了转座元素对基因表达的影响是物种特异性
转座元素(TES)是寄生虫DNA序列,能够沿所有基因组的染色体移动和繁殖。可以通过靶向沉默表观遗传标记来控制它们,这可能会影响包括基因在内的相邻序列的Chro Matin结构。在这项研究中,我们使用了来自几个果蝇Melanogaster的卵巢样品和果蝇Simulans野生型菌株产生的转录组和表观基因组高吞吐量数据,以精细量化Te插入对基因RNA水平和组蛋白标记的影响(H3K9ME3和H3K9ME3和H3K4ME3)。我们的结果揭示了与梅拉·诺加斯特(D. Mela Nogaster)相比,TES对D. simulans中直源基因的表观遗传作用更强。同时,我们发现了D. mel Anogaster基因组中TE对基因H3K9me3的差异的较大贡献,这证明了Te数字周围的Te数与D. melanogaster中这种染色质标记的水平的更强相关性。总体而言,这项工作有助于理解TE在基因组中的物种特异性影响。它为TE提供的可观自然变异性提供了新的启示,这可能与适应性和进化潜力的对比有关。