XiaoMi-AI文件搜索系统
World File Search Systemadenocarcinoma
Trpm8 在人类和小鼠去势抵抗性前列腺腺癌中的表达为基于 TRPM8 的靶向疗法的临床前开发铺平了道路
摘要:转移性前列腺癌 (mPCa) 是美国和欧洲癌症相关死亡的主要原因之一。雄激素剥夺是 mPCa 的一线疗法;然而,不可避免地会出现对治疗的抵抗,并且疾病会发展到无法治愈的去势抵抗阶段。定义新的靶向疗法对于建立创新且更有效的个性化肿瘤治疗方案是必不可少的。我们使用了 PCa 的基因工程小鼠模型和人类样本来表征 TRPM8 阳离子通道在激素幼稚和去势抵抗性肿瘤中的表达。我们发现 Trpm8 表达标记了惰性 (Pten 缺失) 和侵袭性 (Pten/Trp53 双缺失和 TRAMP) 小鼠前列腺腺癌。重要的是,小鼠和人类去势抵抗性 PCa 都保留了 TRPM8 蛋白表达。最后,我们测试了 TRPM8 激动剂 D-3263 与恩杂鲁胺或多西他赛联合使用对侵袭性小鼠 PCa 细胞系活力的影响。我们的数据表明,D-3263 显著增强了恩杂鲁胺和多西他赛在 TRAMP-C1 和 TRAMP-C2 PCa 细胞系中的促凋亡活性。总之,本研究为临床前体内测试 TRPM8 靶向性提供了基础,这是一种实施晚期 PCa 标准治疗疗效的新策略。
迈向治疗测序策略:晚期胃癌/胃食管治疗方案的系统综述
美国伊利诺伊州芝加哥的芝加哥大学医学中心与生物科学; B希望之城综合癌症中心,美国加利福尼亚州杜阿尔特;日本纳戈亚的C Aichi癌症中心医院; D临床癌症研究所Krankenhaus Nordwest,德国法兰克福;美国马萨诸塞州马萨诸塞州马萨诸塞州癌症中心,美国马萨诸塞州,美国;美国加利福尼亚州圣塔莫尼卡圣莫尼卡的FCLA,美国加利福尼亚州圣莫尼卡; G Weill Cornell Medicine,纽约,纽约,美国;韩国首尔大学医学院的H Yonsei癌症中心;我的国家癌症中心医院东部,日本千叶;美国印第安纳州印第安纳波利斯的J Eli Lilly&Co; K消化肿瘤学,大学医院Gasthuisberg Leuven和Ku Leuven,Leuven,Belgium,Belgium†也同样贡献。在本文末尾可以找到潜在的利益冲突的披露。
2024; 15(7): 1983-1993. doi: 10.7150/jca.92823 研究论文 HKDC1 增强胰腺腺癌的增殖、迁移和糖酵解
背景:了解胰腺腺癌 (PAAD) 发展的分子机制对于治疗这种疾病至关重要,因为目前的预后和治疗选择都令人非常沮丧。目的:本研究旨在研究己糖激酶结构域 1 (HKDC1) 在 PAAD 进展中的作用。方法:本研究利用生物信息学技术评估 HKDC1 的表达与临床特征之间的关系。通过体外实验研究 HKDC1 在 PAAD 中的分子机制和生物学功能。结果:本研究的结果表明,HKDC1 在各种类型的人类癌症中表达增加,并且 PAAD 中 HKDC1 表达升高与不良预后之间存在显著相关性。根据单变量和多变量 Cox 回归分析的结果,HKDC1 可以作为诊断患有 PAAD 的个体的独立预后指标。经过计算,我们发现HKDC1高表达组表现出较低的免疫学评分和较高的ESTIMATE评分,这表明免疫浸润评分存在差异。为了验证HKDC1在PAAD细胞系中的表达,我们通过qPCR和蛋白印迹分析了PAAD细胞系。还通过蛋白质印迹检测了人PAAD组织中HKDC1的表达。此外,我们通过菌落形成、5-乙炔基-2′-脱氧尿苷(EdU)、transwell和划痕愈合试验等实验探索了HKDC1在PAAD中的作用。在我们的研究中,我们发现在PAAD细胞类型中HKDC1表达的中断导致细胞生长速度降低并抑制细胞运动和侵袭。结论:总之,我们的研究结果表明HKDC1对PAAD的肿瘤微环境(TME)有显著影响,可能成为PAAD治疗的一个有希望的靶点,为PAAD的管理提供了新的视角。
肺腺癌的病例具有新型CD74 -ROS1融合变体,该变体通过全面的基因组分析鉴定,对克里唑替尼和Entrectectinib做出了反应
一名38岁的女性从未吸烟,在胸部X射线上呈现心脏轮廓扩大,胸部计算机断层扫描(CT)扫描显示左上叶下叶段中有一个小的肺结节,双侧的双侧淋巴结肿大,介质淋巴结和大量的经percardial percardial effusion(图1)。经过支气管肿瘤活检和其他检查显示临床IVA(T1AN3M1A)肺部肺癌。EGFR突变和ALK易位。通过顺铂(pemetrexed和bevacizumab)的五个一线化学疗法进行了部分反应,开始使用pemetrexed和bevacizumab的维持化学疗法。在维护治疗的两个周期后获得了完全反应。第一次诊断四年后,当完成43个维持化疗的周期时,胸部CT扫描在主要病变处显示出很小的阴影(图1(b))。挽救部分叶切除术,并在切除的标本中确认可行的癌细胞。ROS1融合转录本未通过使用Oncoguide®AmoyDX®试剂盒从样品中检测到。他们也对BRAF突变进行了负面影响。手术九个月后,她的肺癌复发了双侧纵隔和肺淋巴结淋巴结,多种骨转移和多个脑转移(图1(c))。几种有症状的脑转移是
抑制骨形态发生蛋白受体 2 可通过调节 GRB2/PI3K/AKT 轴来抑制胰腺导管腺癌的生长
属于肿瘤生长因子-β超家族,通过与1型和2型BMP受体结合启动细胞内BMP信号传导(3)。由BMP/BMPR介导的信号转导已被证明参与多种生物过程,例如胚胎发育过程中的自我更新和干性维持(4)。最近,在乳腺癌和胃癌中检测到骨形态发生蛋白受体2(BMPR2)的异常表达,并且已证明BMPR2的异常表达与肿瘤细胞的增殖、分化和迁移有关(5-7)。然而,BMPR2及其调节机制在PDAC中的作用仍然未知。我们的研究通过使用肿瘤微阵列的免疫组织化学(IHC)确定了与正常胰腺组织相比,PDAC肿瘤中的BMPR2过度表达。抑制BMPR2导致胰腺癌(PC)细胞增殖受抑制和G2/M停滞。通过蛋白质组学分析,我们发现GRB2是BMPR2的潜在靶点,其致癌作用在PC细胞中得到进一步证实。生长因子受体结合蛋白2(GRB2)是一种参与细胞存活、增殖等多种细胞功能的衔接蛋白,也是多种致癌信号通路的重要调节因子(8,9)。GRB2的作用已在许多癌症中得到广泛研究,尤其是乳腺癌(10-12)。我们进行了生物信息学分析,以探索GRB2可能参与的潜在分子机制。体外实验表明,BMPR2通过调节生长因子受体结合蛋白2/磷脂酰肌醇3-激酶/蛋白激酶B(GRB2/PI3K/AKT)通路来调节PC细胞增殖。BMPR2抑制剂LDN193189显着抑制BMPR2诱导的GRB2/PI3K/AKT通路的激活。利用原位 PC 和患者来源的异种移植 (PDX) 模型,我们进一步证明了抑制 BMPR2 可通过抑制体内 GRB2/PI3K/AKT 轴来抑制 PC 生长。在此,我们揭示了 BMPR2 在 PDAC 中的致瘤作用,为使用 BMPR2 抑制剂治疗 PDAC 提供了证据。我们根据 ARRIVE 报告清单(可访问 http://dx.doi. org/10.21037/atm-20-2194)撰写了以下文章。
使用定量SPECT/CT获得的骨骼标准化摄取值,用于检测肺腺癌患者的骨转移酶
结果:研究了115例肺腺癌患者的252例骨转移性病变,140个良性骨病变和199个正常椎骨(48名男性,67名女性,中位年龄:59岁)。转移性病变的SUVMAX(23.85±14.34)明显高于良性病变(9.67±7.47)和正常椎骨(6.19±1.46; p <0.0001)。使用Cuto x suvmax为11.10的骨转移患者的SPECT/CT热点可以与良性病变区分开,灵敏度为87.70%,特异性为80.71%。成骨细胞(29.16±16.63)和混合(26.62±14.97)病变的suvmax明显大于溶质状(15.79±5.57)和ct-negative(15.79±5.57)和(16.51±6.93)的损伤(16.51±6.93)(16.51±6.93)。suvmax在8.135的cuto效应上可以将CT阴性骨转移与正常椎骨区分开,灵敏度为100.00%,特异性峰为91.96%。suvmax在所有骨转移中显示与HUS的正线性弱相关性和所有骨骼病变的体积。
构建具有IRAE和诊所特征的nom图,以预测接受抗PD-1治疗的晚期G/GEJ腺癌患者的存活
方法:组装了255名被诊断为晚期G/ GEJ腺癌的成年患者的数据集。将影响整体生存(OS)至显着程度的IRAE识别为候选变量,并将其整合为候选变量,以及其他12个候选变量。These included gender, age, Eastern cooperative oncology group performance status (ECOG PS) score, tumor stage, human epidermal growth factor receptor 2 (HER2) expression status, presence of peritoneal and liver metastases, year and line of anti-PD-1 treatment, neutrophil-to-lymphocyte ratio (NLR), controlling nutritional status (CONUT) score, and Charlson comorbidity index (CCI)。为了减轻与伊拉斯有关的时机偏见,采用了具有里程碑意义的分析。使用最小绝对收缩和选择算子(LASSO)回归进行了变量选择以查明明显的预测因子,并应用了方差障碍因子来解决多重共线性。随后,使用正向似然比方法进行了COX回归分析来开发生存预测模型,排除未能满足比例危害(PH)假设的变量。该模型是使用整个数据集开发的,然后通过Bootstrap重新采样进行内部验证,并通过另一家医院的同类进行外部验证。此外,创建了一个列图来描述预测模型。
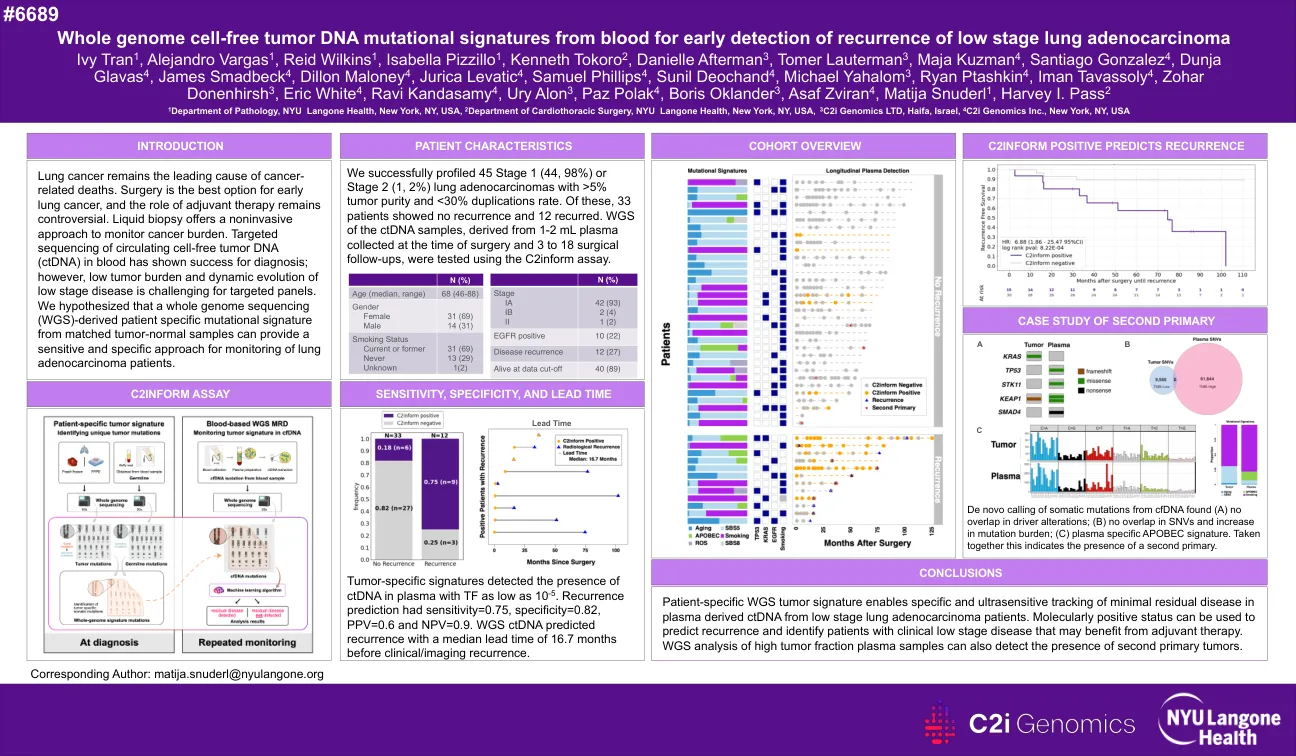
全基因组无细胞的肿瘤DNA突变信号早期发现低阶段肺腺癌的复发
肺癌仍然是癌症相关死亡的主要原因。手术是早期肺癌的最佳选择,辅助治疗的作用仍然有争议。液体活检提供了一种无创的方法来监测癌症负担。血液中循环无细胞肿瘤DNA(CTDNA)的靶向测序已显示出成功的诊断。但是,低肿瘤负担和低阶段疾病的动态演变对于目标面板具有挑战性。我们假设从匹配的肿瘤正常样品中衍生的整个基因组测序(WGS)特定的突变特征可以为监测肺腺癌患者的敏感且特异性的方法提供。
基于NGS比较肺腺癌胸腔积液与转移性淋巴结活检的分子差异及临床疗效评估
为携带特定基因异常的肺腺癌患者带来了显著的获益,携带表皮生长因子受体(EGFR)突变和间变性淋巴瘤激酶(ALK)融合/重排患者的死亡率明显下降(5-6)。针对EGFR突变的靶向药物如表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)已投入临床,部分患者由于T790M等EGFR耐药突变或其他EGFR下游通路激活而在1-2年内产生耐药(7-8)。此外,其他基因突变可能作为肺腺癌的潜在治疗靶点或重要的预后指标(9)。因此,全面、准确地分析肺腺癌的基因突变谱对指导临床治疗选择和预后评估具有重要意义。
比较临床期肺腺癌
高分辨率计算机断层扫描(HRCT)和肺癌筛查已变得更加广泛,并且已经检测到越来越多的外围小肺腺癌(1,2)。据报道,手术切除后约有17%的临床IA患者已被证明具有病理淋巴结转移(LNM)(3)。值得注意的是,这些临床IA病例与通常缺乏LNM的病理IA肺腺癌不同。术前评估未检测到LNM的条件,但术后病理证实LNM称为神秘淋巴结转移(ONM)(4)。为了确保对淋巴结(LN)病变的足够切除,仍然建议将系统的LN解剖作为早期肺腺癌患者的标准方法。这意味着超过80%的临床期IA肺癌患者已经进行了不必要的LN解剖。无效的LN解剖可能会导致术后恢复的延长,并增加了术后并发症的可能性(5-7)。因此,如果可以在手术前准确诊断出ONM,则可以在临床期IA肺腺癌患者中进行靶向LN解剖,以减少不必要的手术损伤。