XiaoMi-AI文件搜索系统
World File Search System表皮生长因子受体抑制剂(PRIDE 综合征)对非小细胞肺癌患者的皮肤副作用:横断面
该研究发现,在接受厄洛替尼、吉非替尼和阿法替尼治疗的 74 名 IV 期非小细胞肺癌患者中,有 47 名(63.5%)出现至少一种皮肤不良事件,这与之前在泰国 9,10、亚洲和欧洲 7,8,14 的研究结果一致。最常见的皮肤不良事件是干燥症 (65.9%),与之前在泰国 9,10 的研究结果一致,但与其他国家(日本 4 、意大利 7 、美国 8 )的结果不太可能一致,最常见的皮疹是丘疹脓疱性皮疹。这是因为 EGFR 抑制剂抑制了表皮生长因子作为皮肤上皮层的屏障,从而导致干燥症。此外,一些患者之前接受过的化疗是细胞毒性药物,导致上皮层的改变。同时,泰国人经常在热带国家用香皂洗澡。尽管如此,并没有标准的标准来评估干燥症。
版权材料
在癌症治疗中,最初的开发努力是通过寻找对癌细胞系有毒性的药物来经验性地发现癌症治疗方法。随着对癌症生物学的深入了解,人们确定了特定的癌症靶点,例如激素受体 (HR)(雌激素、孕酮、雄激素)、人类表皮生长因子家族受体 (HER2、EGFR)、血管内皮生长因子 (VEGF) 受体等。表皮生长因子受体 (EGFR) 靶向治疗的发展历史可能最能体现如何最大限度发挥靶向治疗效果的挑战。最初,EGFR 靶向药物,如吉非替尼和厄洛替尼,被用于治疗所有非小细胞肺癌 (NSCLC) 患者,但只有一小部分患者受益于该疗法。几年后,人们意识到只有患有 EGFR 蛋白突变的肺癌肿瘤的人才会有显著的反应。
2023; 19(3): 789-810. doi: 10.7150/ijbs.79328 综述 核酸与小分子药物联合抗癌治疗的先进策略
癌症被认为是控制细胞增殖、分化和体内平衡的基因突变的复杂恶性后果,因此肿瘤治疗极具挑战性。迄今为止,各种载货分子,包括核酸药物(pDNA、miRNA 和 siRNA)、治疗药物(阿霉素、紫杉醇、柔红霉素和吉非替尼)和成像剂(放射性同位素、荧光染料和 MRI 造影剂)已被视为临床应用的潜在药物。然而,由于肿瘤异质性和多种药物耐药性,非单一治疗药物可以产生令人满意的临床效果,而基于纳米技术的联合治疗正在成为增强抗癌效果的重要先进模式。本综述汇集了当前以纳米药物为基础的联合递送小分子药物和核酸进行抗癌治疗的先进发展。此外,明确介绍了其优越性,并详细讨论了克服临床挑战的障碍。最后,展示了未来药物和核酸联合治疗肿瘤的合理方向。
海胆(Arbacia lixula)肽的分子对接研究是非小细胞肺癌(NSCLC)相关蛋白的多目标抑制剂
Epidermal growth factor receptor (EGFR), phosphoinositide 3-kinase (PI3K), Janus kinase 3 (JAK3) and B-type Raf kinase (BRAF) are proteins that play a role in the growth and development of lung cancer, NSCLC subtype (Lee et al., 2011; El- Telbany and Ma, 2012; Hu et al., 2014).eGFR是一种酪氨酸激酶受体的蛋白质家族,在40-80%的NSCLC病例中过表达(Suzuki等,2005)。与EGF配体结合后,EGFR将激活PI3K/AKT/MTOR途径,BRAF途径和JAK-STAT途径,该途径在细胞增殖和生长中起着至关重要的作用(Andl等,2004; Liu等,2013; Singh等,2019)。因此,可以抑制与癌症作斗争的EGFR活性的化合物,例如Gefitinib和Lapatinib(Brehmer等,2005; Wainberg等,2010)。PI3K是PI3K/AKT1/MTOR途径中的中心蛋白。该途径在肺癌特征中过度活跃 - 在50-70%的NSCLC病例中磷酸化的Akt1过表达(YIP,2015)。PI3K-AKT途径通过灭活下游凋亡因子在细胞表面中起重要作用(Zhuang等,2011)。BRAF是调节细胞生长的BRAF途径中的中央蛋白。大约50%的NSCLC肺癌Paptents在BRAF蛋白中具有V600E突变(Bustamante and Otterson,2019年)。BRAF V600E CAN
新型 c-Met 抑制剂白鲜碱通过下调 PI3K/AKT/mTOR 和 MAPK 信号通路抑制肺癌细胞增殖
白鲜碱 (Dictamnine, Dic) 是一种从白鲜根皮中分离出来的天然小分子呋喃喹啉生物碱,据报道具有抗癌特性。然而,人们对 Dic 的直接靶蛋白和抗癌机制知之甚少。在目前的研究中,发现 Dic 可在体外和体内抑制肺癌细胞的生长,并通过抑制受体酪氨酸激酶 c-Met 的磷酸化和活化来减弱 PI3K/AKT/mTOR 和丝裂原活化蛋白激酶 (MAPK) 信号通路的活化。此外,使用细胞热位移分析 (CETSA) 和药物亲和力响应靶标稳定性 (DARTS) 分析证实了 Dic 与 c-Met 的结合。在所有测试的癌细胞系中,Dic 对 c-Met 依赖性 EBC-1 细胞增殖的抑制作用最强 (IC 50 = 2.811 μ M)。值得注意的是,Dic 显示出协同作用,可提高表皮生长因子受体酪氨酸激酶抑制剂 (EGFR-TKI) 耐药肺癌细胞对吉非替尼和奥希替尼的化学敏感性。这些结果表明,Dic 是一种 c-Met 抑制剂,可作为治疗肺癌的潜在治疗剂,尤其是针对 EGFR TKI 耐药和 c-Met 依赖性肺癌。
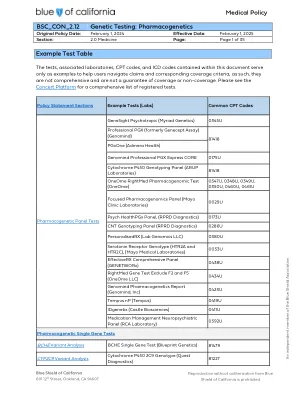
BSC_CON_2.12 基因检测:药物基因组学
答:将成员考虑在后续行动中挥舞着旋转的曲折:1。Eliglustate1(GIC,CERDLE)或2。Tetrabean2(例如,Xenacine)或3。mptaminiary3。amptaminiary 3。amptaminiary 3(adzenys,adzenys,ampespel),ampespel),dyanakes,dyanakes,dyokes,diipp nipp and a vepes,4 (Eech,Aristoted)或6。Atomooxetine6(道德)或7。Brexpopprazle7(Ethat,Rexult)或8。Clospox)或8。Clozine8(for,for,for,for,fast。9Trabbencies 9(g Oxydine 12(Othing,Lightyra),或13。Meclass13。13。14。Mechlopramids14(道德,Reglan,Metozolv)或15。油15(伦理,Ollinvyk)或16. Small 16(Small 16) IP,Ultrami)或21。Valley21(GIC,工程师)或22。Venlafaxine22(Ethice,Efxeer)或23。Vorthox23。23。23。
挽救手术在吉非替尼治疗中的作用......
患者,49岁,女性,2011年行开放性右中叶切除术及系统性淋巴结清扫后诊断为IB期腺癌(图1A),术后接受4个周期的诺华和顺铂辅助化疗。术后4年发现患者同侧肺转移(图1B)。标本基因检测显示外显子21Leu858Arg取代(L858R),患者予口服吉非替尼靶向治疗。靶向治疗3个月后胸部CT扫描示转移灶明显缩小(图1C),每隔3个月复查CT扫描示病变情况稳定。靶向治疗27个月后,转移灶开始增大(图1D),被认为是对吉非替尼产生耐药的表现。经过多学科团队(MDT)讨论,患者接受了电视胸腔镜楔形切除转移灶的挽救性手术。术后病理结果和基因分析提示为腺癌(图2),EGFR L858R和T790M突变。但奥希替尼在中国尚无上市
基于“AND”逻辑门的超分子治疗纳米平台,用于对抗耐药性非小细胞肺癌
尽管有表皮生长因子受体酪氨酸激酶抑制剂 (EGFR-TKI) 等靶向疗法,但由于耐药性阻碍了其疗效,非小细胞肺癌 (NSCLC) 仍然是一个临床挑战。在这里,我们设计了一个基于“AND”逻辑门的超分子治疗平台 (HA-BPY-GEF-NPs),用于治疗 EGFR-TKI 耐药性 NSCLC。该系统集成了需要按照预设顺序激活的内部和外部刺激响应机制,使其能够精确控制药物释放行为,从而提高治疗精度。通过对系统进行编程以响应连续的近红外 (NIR) 辐射和酶 (组织蛋白酶 B) 输入,吉非替尼的释放被有效地限制在肿瘤区域。此外,NIR 辐射会诱导活性氧的产生,抑制肿瘤生长并抑制旁路信号通路。设计的药物输送系统提供了高度控制和针对性的治疗方法,有效抑制肿瘤生长,抑制旁路信号通路,克服EGFR-TKI耐药性,从而为最大化治疗效益提供了潜在的解决方案。
第四代表皮生长因子受体...
非小细胞肺癌(NSCLC)中表皮生长因子受体(EGFR)突变是最常见的驱动突变之一,尤其在某些人群中,例如亚洲患者和非吸烟者。外显子19的缺失和外显子21的L858R点突变是最常见的异常,两者合计占所有EGFR突变的80%以上(1)。在过去的二十年里,靶向治疗的出现深刻改变了晚期驱动基因阳性NSCLC患者的治疗策略。作为NSCLC的重要治疗靶点,EGFR酪氨酸激酶抑制剂(EGFR-TKI)彻底改写了EGFR突变型NSCLC患者的诊断和治疗(2)。与传统化疗相比,第一代(如吉非替尼和厄洛替尼)和第二代(如阿法替尼)EGFR-TKI已显示出更高的反应率和无进展生存期(PFS)。第三代 EGFR-TKI(如奥希替尼)的开发主要是为了克服由于 T790M 耐药突变而对早期 EGFR-TKI 产生的获得性耐药性,这是对早期 EGFR-TKI 产生耐药性的常见机制 (3)。奥希替尼还显示出作为 EGFR 突变 NSCLC 患者的一线治疗药物的疗效,因为它能够靶向常见的激活性 EGFR 突变和 T790M
对设计的苯咪唑衍生物的分子对接分析为EGFR
摘要非小细胞肺(NSCL)和结直肠癌经常与表皮生长因子受体(EGFR)的致癌激活相关,这是受体酪氨酸激酶(RTK)家族的成员。当前的酪氨酸激酶抑制剂(TKI)容易受到耐药性突变的影响,并诱导了对正常EGFR S的细胞毒性作用。带嘌呤的苯咪唑的同余性质具有模仿基于嘌呤的ATP的结合模式并防止其与EGFR活性位点的接触的巨大潜力。在这里,我们报告了50种设计的苯咪唑衍生物以及Gefitinib和ATP的分子对接,以分析和比较EGFR WT和T790M活性位点的结合模式。配体的设计基于我们先前的研究,我们建议评估与双键接头的酮和氨基 - 苯并咪唑,以及在各个位置附有电子捐赠和电子撤回的苯基基团。对接模拟表明,酮苯并咪唑在两个EGFR配合物中占据了前十名最高结合亲和力。与其他具有-8.1(7C)和-7.8(11C)KCAL/MOL在EGFR WT中的结合能相比,具有更稳定的复合物的磺酰基取代基的存在,eGFR WT中的结合能,-8.3(7d)和-8.4(7d)和-8.4(1c)kcal/mol for t790m t790m for T790m。对苯咪唑的取代影响不仅有助于氢键和疏水相互作用,而且还对经常被转化的范德华力的力,这些力是负责苯并咪唑与EGFR结合口袋的形状互补性的负责。