XiaoMi-AI文件搜索系统
World File Search System塔斯马尼亚州政府为高危人群提供乙肝疫苗资助
• 前往乙肝病毒流行地区的旅行者; • 因工作接触血液的人; • 有患更严重肝炎风险和/或有医源性感染风险的人,包括患有慢性肝病的人、正在接受或即将接受血液透析的成年人、器官移植接受者、免疫功能低下者、血液制品接受者和发育迟缓者。这些群体中的人通常已通过其主要或专业提供者接种疫苗。
研究发现乙肝疫苗不会增加早产儿患慢性肺病的风险
这项研究是世界上规模最大的研究,涉及维多利亚州的 818 名早产婴儿,研究使用了疫苗安全健康链接。该链接将多个全州免疫和健康结果数据集整合在一起。研究发现,接种疫苗的婴儿中有 51% 会患上 BPD,而未接种疫苗的婴儿中这一比例为 62%。
影响肯尼亚医学院乙肝疫苗接种的因素:一项混合方法研究
背景:乙肝病毒 (HBV) 在撒哈拉以南非洲地区高度流行,70% 至 90% 的人口在 40 岁之前感染。由于职业暴露,包括医护学生 (HCS) 在内的医护工作者 (HCW) 感染 HBV 的风险较高。HCS 尤其面临高风险,因为他们不熟悉感染控制程序,并且对与患者打交道时的风险水平了解不足。尽管有一种有效的疫苗可用,并且肯尼亚卫生部也建议接种,但很少有 HCW 和学生接种疫苗。本研究旨在评估意识、态度、实践和获取因素对肯尼亚医学培训学院 (KMTC) 的 HCS 接种乙肝疫苗的影响。方法:这是一项并行混合方法研究。对于定量部分,使用结构化问卷来评估对 HBV 疾病和疫苗接种的意识、知识、态度和实践。还评估了参与校园中 HBV 疫苗的可及性。进行了两次焦点小组讨论:一次由参与校园的学生代表组成,另一次由教职员工组成。定量数据使用 STATA(版本 15)进行分析,定性数据使用 NVIVO(版本 11)。
乙肝 - 全球疫苗和免疫联盟
挑战 2004 年,153 个国家在其常规婴儿免疫计划中使用乙肝疫苗,全球乙肝疫苗覆盖率为 48%。在 2004 年未接种乙肝疫苗的近 6500 万名儿童中,近 5500 万名(84.5%)来自 GAVI 合格国家。在有资格获得 GAVI 联盟支持的国家中,六个国家未接种疫苗的儿童数量最多:印度、尼日利亚、中国、孟加拉国、埃塞俄比亚和刚果民主共和国。
与糖尿病共存的健康生活:接种所需的疫苗
• 乙肝可通过共用血糖仪、指尖采血设备或其他糖尿病护理设备(如胰岛素笔)传播。为防止感染乙肝,切勿共用糖尿病护理设备。CDC 建议所有未接种疫苗的 60 岁以下糖尿病成年人接种乙肝疫苗。许多人小时候就接种过乙肝疫苗,因此请咨询您的医生,看看您是否已经接种过疫苗。如果您年满 60 岁,请咨询您的医生,看看您是否应该接种乙肝疫苗。1
乙型肝炎申报表.pdf
我理解,由于我在工作中接触血液或其他潜在传染性物质,我可能面临感染乙肝病毒 (HBV) 的风险。我有机会免费接种乙肝疫苗;但是,我目前拒绝接种乙肝疫苗。我理解,拒绝接种这种疫苗会让我继续面临感染乙肝这种严重疾病的风险。如果将来我继续在工作中接触血液或其他潜在传染性物质,并且我想接种乙肝疫苗,我可以免费接种一系列疫苗。
乙肝表面抗原(HBsAg)检测
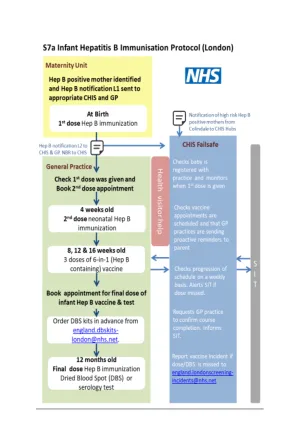
* 乙肝感染母亲所生的婴儿应在出生和 4 周时接种一剂含乙肝疫苗。他们还应在 8 周、12 周和 16 周时接种含六价乙肝疫苗(六合一疫苗)。一岁时再接种一剂单价乙肝疫苗,同时进行 HBsAg 检测。如果初级疗程中断,应恢复但不要重复,剩余六价疫苗剂量之间应间隔四周。
亲爱的同事,关于疫苗接种和免疫的最新信息......
乙肝疫苗使用高剂量乙肝疫苗对于一些高风险患者,我们可能建议每年检查乙肝表面抗体(HBsAb)水平,如果HBsAb滴度<10 mIU / mL)给予加强剂量
乙肝疫苗和乙肝免疫球蛋白的推荐剂量,包括乙肝联合疫苗、单抗原疫苗
4 青少年 2 剂系列 - 默克公司的 2 剂成人 Recombivax HB®(10mcg,1 ml)仅用于 11-15 岁的青少年,分别在 0 和 4-6 个月时注射。文件必须表明青少年接受了 2 剂成人(10mcg,1ml)默克品牌疫苗。如果儿童在 11 岁之前开始接种乙肝疫苗系列,在 11 至 15 岁之间接种其他品牌的乙肝疫苗,或在 15 岁后完成系列接种,则应进行 3 剂系列接种。5 Recombivax HB® 透析制剂获准用于 20 岁及以上的成人血液透析和免疫功能低下人群,在 0、1 和 6 个月时进行 3 剂系列接种(40mcg/1mL)。 6 Heplisav-B – Dynavax 的 2 剂系列疫苗,适用于 0 个月和 1 个月龄的 18 岁及以上人群;可作为其他品牌乙肝疫苗 3 剂系列疫苗的替代品。7 PreHevbrio™ - VBI 的 3 剂系列疫苗,适用于 0 个月、1 个月和 6 个月龄的 18 岁及以上人群。8 Pediarix ®(DTaP、乙肝和 IPV)- 葛兰素史克 (GSK) 的联合疫苗,可替代单一抗原,在 2 个月、4 个月和 6 个月龄时接种。这种联合疫苗不能在出生时接种。它可以接种给 6 周至 7 岁之间任何没有抗原禁忌症的儿童,并且只能作为基础系列疫苗接种。(基础系列疫苗被视为 DTaP 和 IPV 疫苗的前三剂)。 4 剂乙肝疫苗系列已获批准,出生时接种一剂乙肝抗原疫苗,随后再接种 3 剂这种乙肝联合疫苗。9 Vaxelis TM (DTaP、IPV、HIB、HepB) – 默克和赛诺菲巴斯德 (MSP) 联合疫苗,分别在 2、4 和 6 个月大时接种。出生时不得接种。任何 6 周至 4 岁之间的儿童均可接种,无需
19-59 岁成人普遍接种乙肝疫苗的最新建议——美国,2024 年
2024 年 9 月 11 日,食品药品管理局批准了一项请求,更新 Heplisav-B 疫苗标签,增加适用于孕妇的新适应症(3、4)。一项上市后观察性回顾性队列研究 (DV2-HBV-28)* 纳入了 75 例已知结果的妊娠,其中 10 例在受孕前 28 天至妊娠结束期间接受过两次 Heplisav-B 治疗。在 75 名怀孕前或怀孕期间接触过 Heplisav-B 的孕妇中,44 人在受孕前 28 天接受过 Heplisav-B 治疗,24 人在妊娠前三个月接受过 Heplisav-B 治疗,6 人在妊娠中期接受过 Heplisav-B 治疗,1 人在妊娠晚期接受过治疗。未发现重大出生缺陷,流产风险低于估计的背景风险。这些可用数据主要针对在受孕前 28 天或怀孕期间接受过 1 剂 Heplisav-B 的人,并不表明重大出生缺陷和流产的风险增加。美国食品药品管理局根据《公共卫生服务法》第 351(a) 条 † 批准重组佐剂型乙肝疫苗 (HEPLISAV-B),更新包装说明书以包括来自研究 DV2-HBV-28 的数据,允许使用 Heplisav-B 为需要接种乙肝疫苗的孕妇接种疫苗 ( 3 , 4 )。