XiaoMi-AI文件搜索系统
World File Search System达特茅斯员工/学生乙肝疫苗接种同意/拒绝表格说明:一旦员工/学生接受了血液
达特茅斯员工/学生乙肝疫苗接种同意/拒绝表格说明:员工/学生接受血源性病原体、乙肝病毒和乙肝疫苗接种方面的培训后,必须签署以下声明之一并将其提交给环境健康与安全 (EHS) (HB 6216)。EHS 收到此表格后,将向员工/学生提供在 Dick's House 接种疫苗的凭证。我理解,作为我的工作或学习领域的一部分,我可能会接触血液或其他潜在传染性物品或材料,这些物品或材料使我面临感染乙肝病毒 (HBV) 的风险。因此,我免费接种了乙肝疫苗,旨在使我对 HBV 产生免疫力。至少需要三次单独的肌肉注射才能产生所需的免疫力(有时需要额外注射才能达到免疫力),并且必须注射所有三剂疫苗才能使疫苗有效。同意声明 我了解上述内容并请求接种乙肝疫苗系列。 姓名(印刷体):____________________________________ Hinman Box:_________________ 签名:______________________________________ 日期:______________________ DND(网络 ID)#:___________________________________ 确认先前接种过疫苗声明 我了解上述内容,并且我已经接种了整个 HBV 疫苗系列。 姓名(印刷体):____________________________________ 接种日期:___________ 签名:______________________________________ 日期:____________________________________ 拒绝声明 我了解上述内容,并且我了解由于我在职业上接触血液或其他潜在传染性物质,我可能有感染乙肝病毒 (HBV) 的风险。 我有机会免费接种乙肝疫苗;但是,我这次拒绝接种乙肝疫苗。 我了解拒绝接种这种疫苗会继续让我面临感染乙肝这种严重疾病的风险。如果将来我继续在工作中接触血液或其他潜在传染性物质,并且我想接种乙肝疫苗,我可以免费接种疫苗。姓名(印刷体):____________________________________ 签名:______________________________________
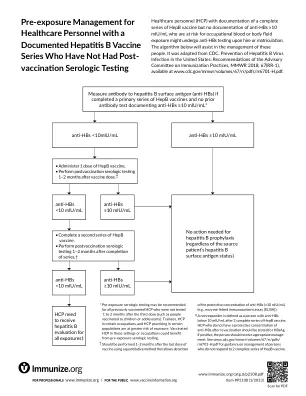
已接种乙肝疫苗但未进行接种后血清学检测的医护人员的暴露前管理
有完整乙肝疫苗接种记录但没有抗-HBs ≥10 mIU/mL 记录的医护人员 (HCP) 可能在入职或入职时接受抗-HBs 检测,并且有职业性血液或体液暴露风险。以下流程将有助于管理这些人。它改编自 CDC。美国乙型肝炎病毒感染预防:免疫实践咨询委员会的建议,MMWR 2018;67(RR-1),可在 www.cdc.gov/mmwr/volumes/67/rr/pdfs/rr6701-H.pdf 上查阅。
欧洲医疗专业人员对高危成人甲肝和乙肝疫苗接种的知识、态度和实践
摘要:尽管过去几十年来欧洲发生了数起甲型肝炎 (hepA) 和乙型肝炎 (hepB) 疫情,但并非所有欧洲国家都已在其国家免疫计划中实施了 hepA 和 hepB 疫苗接种,尤其是对于有感染 hepA 和/或 hepB 风险的成年人,例如男男性行为者或患有慢性肝病的患者。目前,人们对欧洲医疗保健专业人员 (HCP) 对高风险成年人接种 hepA 和 hepB 疫苗的态度知之甚少。我们在德国、西班牙和英国的 HCP 中进行了一项在线调查,以评估他们对高风险成年人国家 hepA 和 hepB 疫苗接种指南的认识和遵守情况。在接受调查的 698 名 HCP 中,大多数 (91.1%) 都熟悉国家疫苗接种建议,并且在建议或开具 hepA 或 hepB 疫苗时始终遵循或大多数时候遵循这些建议。推荐或接种此类疫苗的主要和中等障碍是患者未披露风险因素(53.0–57.6%)以及患者缺乏动力或对疾病风险的了解(50.3–52.9%)。这些结果可能有助于制定改善和加速欧洲高危成人甲肝和乙肝疫苗接种的策略。
儿童免疫疫苗处方集
703448001 HAVRIX JUNIOR S/DOSE 0.5ML 甲型肝炎疫苗注射 720 EL 单位/0.5ML 700513001 AVAXIM PREF SYR 80 0.5ML 甲型肝炎疫苗注射 80 单位/0.5ML 873179005 HEPACCINE-B PAED SINGLE D 乙型肝炎疫苗注射 3 MCG/ML 701658001 HEBERBIOVAC HB SGL D 0.5ML 乙型肝炎疫苗 (重组) SUSP 10 MCG/0.5M 700356001 ENGERIX-B PAED MONODOSE 乙型肝炎疫苗 (重组) 10 MCG/0.5ML 700210001 ENGERIX-B 新单剂量 20MCG 乙肝疫苗 (重组) 20 MCG/ML 701659001 HEBERBIOVAC HB SGL D 1ML PA 乙肝疫苗 (重组) 20 MCG/ML 713048002 EUVAX B 小瓶 20MCG/ML 乙肝疫苗 (重组) 20 MCG/ML 715349001 EUVAX B 小瓶 20MCG/ML 乙肝疫苗 (重组) 20 MCG/ML 700210002 ENGERIX-B 新单剂量 20MCG 1 乙肝疫苗 (重组) 20 MCG/ML 713048001 EUVAX B VIAL 20MCG/ML 疫苗 乙肝疫苗(重组) 20 MCG/ML 722290001 MEASBIO 多剂量粉剂 VIAL 麻疹病毒疫苗(INJ) 3002554002 麻疹疫苗 CIPLA VIAL POW 麻疹病毒疫苗(INJ) 3002554001 麻疹疫苗 CIPLA VIAL POW 麻疹病毒疫苗(INJ) 823678008 OPV-MERIEUX 10 剂量脊髓灰质炎病毒疫苗,口服活疫苗溶液 823686019 OPV-MERIEUX 20 剂量脊髓灰质炎病毒疫苗,口服活疫苗溶液841307016 OPV-MERIEUX 10 剂量塑料脊髓灰质炎疫苗,活口服溶液
纽约州惩教和社区部门...
• • 授权接种乙肝疫苗(是,我想要接种疫苗)我了解所要求疫苗的益处和风险并要求将疫苗接种给我或我有权代表其提供同意的人。 • • 拒绝接种乙肝疫苗(不,我不想接种疫苗)我了解所要求疫苗的益处和风险并要求不要将疫苗接种给我或我有权代表其提供同意的上述人。我了解如果拒绝接种此疫苗,我或我有权代表其同意此请求的人将继续面临感染乙肝这种严重疾病的风险。如果我将来继续在职业或其他方面接触血液或其他潜在传染性物质,并且我想要接种乙肝疫苗,我可以随时接种系列疫苗。 其他疫苗 • • 我已收到并阅读,或有人向我解释了最新的疫苗信息表 (VIS):______________________________________。我有机会提出问题并得到满意的答复。
我国疫苗管理法实施前后2013—2020年婴儿接种乙肝疫苗不良反应报告变化
• 疫苗接种率高对预防感染至关重要,而感染是中国社会和公共卫生的沉重疾病负担。随着监测灵敏度的提高,迄今为止尚未探索出 AEFI 报告的变化规律。 • 疫苗管理法大大提高了乙肝疫苗接种后 AEFI 监测的灵敏度。 • 在报告的最常见 AEFI 中,绝大多数是局部和全身反应,包括发热、发红和硬结。 • 本研究表明严重异常反应的数量和特征保持稳定。 • 2013 年至 2020 年乙肝疫苗接种事件后 AEFI 监测的灵敏度有所提高,12 个月以下儿童乙肝相关 AEFI 保持可预测性,再次证实了其使用安全性。 • 法大大提高了乙肝 AEFI 的监测能力和灵敏度,也有助于增强公众对乙肝疫苗接种的信心。
无薪实习生疫苗接种证明表格
注意:乙肝疫苗是唯一一种实习生不强制接种的疫苗。如果您将在可能接触血液或体液的临床区域工作,建议您接种疫苗。如果您尚未接种疫苗系列,或者您的乙肝滴度结果为无反应或阴性,并且您希望拒绝接种疫苗,请在下面签名。通过在下面签名,您承认您了解不接种疫苗和拒绝接种乙肝疫苗的风险。实习生签名:___________________________________________________________________
2022 – 2030 年全球卫生部门战略
◗ 宣传采取及时有效的干预措施的必要性,对检测呈阳性的孕妇进行治疗,防止将感染传染给婴儿;为孕妇及其伴侣提供咨询;安全分娩;对接触病毒的婴儿进行随访,包括接种出生剂量的乙肝疫苗和完成三剂系列乙肝疫苗的接种。
CDC 临时指导,防止母婴传播乙肝病毒
• 应尽一切努力确保接触 HBV 的婴儿按照 ACIP 建议完成乙肝疫苗系列接种(请参阅 https://www.cdc.gov/mmwr/volumes/67/rr/rr6701a1.htm )。使用单组分疫苗且免疫服务中断的供应商应尽可能按照建议的间隔接种乙肝疫苗,包括在 6 个月时完成系列接种,并按照 ACIP 建议进行接种后血清学检测。 • 如果接种后血清学检测延迟到乙肝系列接种完成后 6 个月以上,供应商应考虑接种单抗原乙肝疫苗的“加强”剂量,然后在“加强”剂量后 1-2 个月安排接种后血清学检测(HBsAg 和 HBsAg 抗体 [抗 HBs])。