XiaoMi-AI文件搜索系统
World File Search System公共服务医疗保健计划 - 先前批准的先前授权药物的处方药剂量增加
我授权加拿大生活,任何医疗保健或牙科保健提供者,我的计划发起人,联邦PSHCP管理局,其他保险或再保险公司,政府福利计划的管理人员或其他福利计划,其他组织或与加拿大境内或加拿大境内生活的服务提供商,以这些目的的目的交换个人信息。我了解,个人信息可能会披露根据加拿大境内或境外适用法律授权的人的披露。
选择适合您的医疗计划
有关承保服务、自付额、共付额、共同保险、非参与提供商福利和其他详细信息的概述,请参阅每个计划的福利摘要。虽然我们建议所有会员都选择初级保健提供者 (PCP),但有些计划要求为每个已登记的家庭成员选择 PCP。请在下面提供该选择。如果需要,请使用表格背面的额外空间。
免疫记录和IGRA血液测试要求
•首次阳性IGRA结果需要进行胸部X射线检查,并由初级保健提供者或当地卫生部进行评估。X射线报告和医疗文档必须提交•潜在或活跃的结核病病史需要在过去一年内进行胸部X射线检查以及治疗文献。X射线报告和治疗文件必须提交
WIR提供商常见问题解答 - 威斯康星州卫生服务部
WIR,威斯康星州的电子免疫记录,于1999年创建。在此期间之前的任何免疫数据都保存在纸质记录上。免疫提供者输入了WIR记录上的信息。如果缺少信息,则需要从提供商那里获得。如果客户拥有其免疫记录或疫苗接种证明的副本(在纸上或来自其他电子或数字记录中),则应向初级保健提供者(PCP),其他疫苗接种提供商或当地卫生部门(LHD)介绍免疫记录或疫苗接种证明,并要求他们向无线添加免疫接种。如果客户没有其免疫记录或疫苗接种证明的副本,则客户将需要与为他们接种疫苗的提供商,卫生部门或客户长大的学校接触,并查看他们是否可以向客户发送其免疫记录的副本。一旦客户获得副本,他们就可以向其初级保健提供者,其他疫苗接种提供者或威斯康星州当地卫生部门提供免疫记录或疫苗接种证明,以向WIR增加免疫接种。在卫生服务部网站上找到所有LHD的清单和联系信息。5。我在WIR中的免疫记录缺失了我知道我收到的疫苗接种。如何
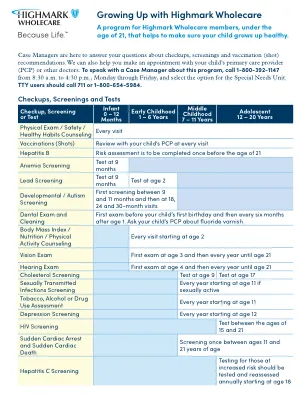
使用Highmark Wholecare长大
案例经理在这里回答您有关检查,筛查和疫苗接种(SHOT)建议的问题。我们还可以帮助您与孩子的初级保健提供者(PCP)或其他医生预约。要与案例经理谈谈此计划,请致电1-800-392-1147,从上午8:30到下午4:30,星期一至周五下午4:30,然后选择特殊需求单元的选项。TTY用户应致电711或1-800-654-5984。
请求品牌处方药覆盖范围
我授权加拿大生活,任何医疗保健或牙科保健提供者,我的计划发起人,联邦PSHCP管理局,其他保险或再保险公司,政府福利计划的管理人员或其他福利计划,其他组织或与加拿大境内或加拿大境内生活的服务提供商,以这些目的的目的交换个人信息。我了解,个人信息可能会披露根据加拿大境内或境外适用法律授权的人的披露。
公共服务医疗保健计划分配费用限制例外表
我授权加拿大生活,任何医疗保健或牙科保健提供者,我的计划发起人,联邦PSHCP管理局,其他保险或再保险公司,政府福利计划的管理人员或其他福利计划,其他组织或与加拿大境内或加拿大境内生活的服务提供商,以这些目的的目的交换个人信息。我了解,个人信息可能会披露根据加拿大境内或境外适用法律授权的人的披露。
老年人高危呼吸道合胞病毒 (RSV) 疫苗接种计划情况说明书 - 疫苗接种者 V4.0
不符合公共资助的呼吸道合胞病毒疫苗计划资格的 60 岁及以上人士可以凭其初级保健提供者的处方在药房接种疫苗。在当地药房接种呼吸道合胞病毒疫苗的个人将需要自费从私人市场购买疫苗。卫生部不报销公共资助的疫苗或从私人市场购买的疫苗。一些私人保险公司可能会承担疫苗的全部或部分费用。
初级保健医生认证和证明表
《社会保障法》第 1902(a)(13)(C) 条规定,主要专业为家庭医学、普通内科或儿科的医生是初级保健提供者。那些为指定代码提供评估和管理代码以及与疫苗和类毒素免疫管理相关的服务的人员将有资格获得报销。根据 42 CFR 447“服务付款”中的提议,为了有资格获得增加的付款,必须满足以下要求。