XiaoMi-AI文件搜索系统
World File Search System一项更容易在皮夹上的健康计划,并在生活发生时提供了所需的备份
对远程医疗服务的限制,也称为虚拟访问或远程医疗,因州而异。这些服务不能替代急诊护理,也不打算替换您的网络中的初级保健提供者或其他提供商。何时使用远程医疗服务的任何描述仅用于信息目的,不应将其解释为医疗建议。请参阅您的保险证据,以获取有关您的计划可能涵盖的内容或可能适用的其他规则的更多详细信息。
威斯康星州最年幼儿童接种 COVID-19 疫苗
DHS 正在积极规划为威斯康星州最小的儿童接种疫苗。威斯康星州卫生服务部 (DHS) 计划为 6 个月至 5 岁的儿童推出新的 Moderna(蓝帽)疫苗和/或为 6 个月至 4 岁的儿童推出辉瑞(栗色帽)疫苗。DHS 希望这项工作能得到全州许多合作伙伴的参与。我们需要您的帮助,为年幼儿童接种 COVID-19 疫苗。药房在为年幼儿童接种 COVID-19 疫苗方面发挥着重要作用。许多父母会带着 6 个月及以上的孩子去儿科医生或初级保健提供者那里接种疫苗。但是,许多父母仍将依靠您为年幼的孩子接种疫苗,尤其是那些居住在儿科医生和其他初级保健提供者有限或医疗服务不足地区家庭的家庭。联邦行动和威斯康星州法律允许为年幼儿童接种药房疫苗。自 2020 年 3 月起,联邦政府临时授权药剂师为 3 岁及以上儿童订购和接种 COVID-19 疫苗和其他推荐疫苗。自卫生和公共服务部部长根据《公共准备和应急准备 (PREP) 法案》发布声明并随附指南以来,这项授权已被暂时允许。
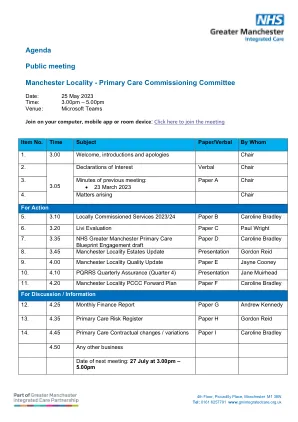
议程公开会议曼彻斯特地区 - 主要...
汤姆·辛奇克利夫(Tom Hinchcliffe) - 主席(TH) - 基于副地的铅,NHS GM(曼彻斯特地区)卡罗琳·布拉德利(CB) - NHS GM(曼彻斯特地区)副主任Carolina Ciliento(CC)副主任(CC)戈登·里德(Gordon Reid)(GR) - NHS GM(曼彻斯特地区)初级保健副主管汤姆·哈灵顿(THA) - 耐心和公共咨询小组主席安德鲁·肯尼迪(Ank) - 地区融资领导者,NHS GM(Manchester Localitaly) LPC地区负责人(曼彻斯特),初级保健提供者代表,社区药房Vish Mehra(VM) - GP董事会主席,初级保健提供者代表,出席的一般实践-Darren Parsonage(DP),Humera Ahmed(HAMed(HA),Kay Hussain(Kay Hussain(KH),Kay Hussain(kh),Paul Wright(PW),Sophie Porter - Sophie Porter - 注意(SP)。公众出勤-Penny Frantzescou(PF),Adam Webster(AW),Emma Greetham(EG)。道歉:珍妮·奥斯本(Jo)(乔),莎拉·弗隆(SF),戴维·里根(David Regan)(博士),劳拉·沙阿(Lara Shah)(LS)。项目详细信息
肺炎球菌15价结合疫苗(Pneu-C-15)
我可以在哪里接种疫苗?儿童可以通过当地公共卫生办公室或初级保健提供者接种疫苗。更多信息如果您的孩子有任何健康问题或过敏,请告知您的免疫接种提供者。您的免疫接种提供者将为您提供您孩子的免疫接种记录。请将此记录保存在安全的地方,并在下次免疫接种时随身携带。如果您的孩子对疫苗有任何异常反应,或者您有任何问题或担忧,
肺炎球菌 20 价结合疫苗 (Pneu-C-20)
更多信息 如果您或您的孩子有任何健康问题或过敏,请告知您的免疫接种提供者。您的免疫接种提供者将为您提供您或您孩子的免疫接种记录。将此记录保存在安全的地方,并在下次免疫接种时随身携带。如果您或您的孩子对疫苗有任何不寻常的反应,或者您有任何问题或疑虑,请联系您的初级保健提供者或公共卫生办公室。有用的网站:
QCH TRUE NORTH 战略计划 - 2023 年至 2028 年
然后我们开始倾听。在第一阶段,我们与许多利益相关者进行了多次对话,以获取他们的意见。事实上,通过焦点小组、会议、研讨会、调查和务虚会,我们收集了 1,500 多个观点。我们从 QCH 的员工、医生、管理层和领导层开始。然后我们向外走,与患者、家庭和护理人员、QCH 志愿者、初级保健提供者、社区组织、市政服务机构、来自渥太华地区的市议会代表、教育机构和其他医疗保健服务合作伙伴交谈。
停止在您不使用的保险上花钱! -Kelseycare
对远程医疗服务的限制,也称为虚拟访问或远程医疗,因州而异。这些服务不能替代急诊护理,也不打算替换您的网络中的初级保健提供者或其他提供商。何时使用远程医疗服务的任何描述仅用于信息目的,不应将其解释为医疗建议。请参阅您的保险证据,以获取有关您的计划可能涵盖的内容或可能适用的其他规则的更多详细信息。
路易斯安那州
不能理解为代替每年与个人初级保健或家庭医生进行的预防性访问。 在接种疫苗之前,访问路易斯安那州儿童全州免疫网络 (LINKS),按照免疫实践咨询委员会 (ACIP) 验证是否正确使用,以防止重复、不必要的剂量、不适当的年龄等。 在接种疫苗时或之后尽快向路易斯安那州卫生部公共卫生办公室的 LINKS 报告每次免疫接种情况。 将观察到的所有不良事件或向药剂师报告的不良事件报告给疫苗不良事件报告系统或其后续计划;此外,药剂师应将发生不良事件的患者转诊给适当的医疗机构。 在进行任何免疫接种之前,索取患者初级保健提供者的姓名。药剂师应尽快通过书面或电子通信方式通知初级保健提供者已接种疫苗。 确保负责管理 COVID-19 疫苗的药房技术人员和/或州授权的药房实习生符合 PREP 法案的资格要求。合格的药房技术人员和/或州授权的药房实习生在合格药剂师的监督下工作。合格药房技术人员和/或州授权的实习生的监督合格药剂师必须遵守 CDC、州和联邦对 COVID-19 疫苗管理的要求。