XiaoMi-AI文件搜索系统
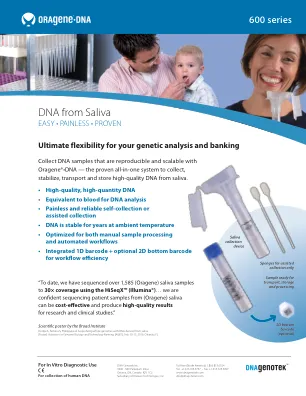
World File Search Systemsaliva的DNA
1预期的收率取决于供体抽取体积和选择的提取方法。2人群和实验室方法对DNA产量和可变性的影响。DNA Genotek。PD-WP-00031。3 Oragene DX产品手册PD-HB-00001_ISSUE10。4非侵入性,辅助收集幼儿唾液的高量和质量基因组DNA。DNA Genotek。PD-WP-018。5 Birnboim HC,Iwasiow RM,James CMP。(2008)。使用Oragene自我收集试剂盒收集的唾液样品的人类基因组DNA含量。
简要审查了龋齿和龋齿疫苗的免疫学
抽象的龋齿是牙齿钙化组织的不可逆的微生物疾病,其特征是无机部分脱矿物和牙齿有机物质的破坏,这通常会导致空气。未经治疗的牙齿龋齿是落叶牙齿的第十个最普遍,也是第四位最昂贵的慢性疾病,可治疗全球儿童的病情,患病率达到六岁。活性龋齿的个体的血清抗体水平升高。的发现还表明,抗原负荷增加(病变细菌)会导致唾液抗体升高。具有选择性IgA缺乏症的受试者没有唾液抗体的牙齿水平显着升高。IgA缺乏IgM补偿性抗体的受试者的龋齿明显少于简单的IgA缺乏受试者。 分泌物中的免疫系统已用于通过刺激适当抗原的唾液抗体来干扰龋齿。 牙龈裂缝液会贡献IgG,这也可能干扰龋齿。 本评论文章强调了关于龋齿免疫学方面的全面和当代观念,以及有关龋齿和免疫力以及龋齿疫苗领域的最新进步的概述。IgA缺乏IgM补偿性抗体的受试者的龋齿明显少于简单的IgA缺乏受试者。分泌物中的免疫系统已用于通过刺激适当抗原的唾液抗体来干扰龋齿。牙龈裂缝液会贡献IgG,这也可能干扰龋齿。本评论文章强调了关于龋齿免疫学方面的全面和当代观念,以及有关龋齿和免疫力以及龋齿疫苗领域的最新进步的概述。
B细胞恶性肿瘤的正向和反向遗传学
背景:绿叶蔬菜(GLV)含有无机硝酸盐,该阴离子对口服微生物组具有潜在的益生元作用。然而,尚不清楚GLV和药理学补充[硝酸钾(PN)是否具有硝酸盐盐会引起对口腔微生物组的类似作用。目标:本研究旨在将GLV与PN补充对高血压个体中口腔微生物组组成和唾液生物标志物的影响进行比较。方法:将70个人随机分配给3个不同的组,以进行5周的饮食干预。第1组以GLV的形式消耗300 mg/d的硝酸盐。第2组食用的药丸,含300 mg/d的PN和低硝酸盐蔬菜。第3组用氯化钾(安慰剂:PLAC)和低硝酸盐蔬菜食用的药丸。在饮食干预之前和之后分析了口腔微生物组组成和口腔健康的唾液生物标志物。结果:GLV和PN组显示出类似的微生物变化,可能依赖硝酸盐,包括奈瑟氏菌,cap虫,弯曲杆菌,弯曲杆菌的丰富度增加,以及治疗后Veillonella,Megasphaera,segasphaera,megasphaera,sectinoryces和eubacterium种类的降低。在GLV组中观察到了Rothia物种的丰度,链球菌,Prevotella,放线菌和摩菌细菌的丰度降低,这可能是硝酸盐独立的。GLV和PN处理增加了唾液pH值,但只有GLV治疗显示唾液缓冲能力和乳酸降低的增加。结论:与PN相比,GLV组中硝酸盐依赖性和独立的微生物变化的结合对改善口服健康生物标志物具有更强的作用。
代谢物
摘要:广义焦虑症(GAD)是一种普遍的障碍。对生物标志物的搜索可能有助于有关分子发病机理和治疗的新知识。由于氧化应激和微量营养素失衡在精神障碍发展中起着关键作用,因此我们旨在研究GAD患者的唾液抗氧化能力和镁,以解决增加复杂性的问题的焦虑模型。该研究子组由15例GAD患者和17名相同年龄的健康志愿者组成,构成了对照亚组。参与者参加了六个级别的困难,其中包括错误的反馈。在此测试中,要求参与者记住气球的颜色,并在颜色改变时做出反应。评估了反应时间,正确答案的数量以及生化参数,例如唾液和唾液镁的抗氧化能力。子组之间的任务结果没有差异。但是,由于反馈和额外的负面心理情感负荷,焦虑的参与者在实验挫败感时花费了更多的时间。在实验会议之前和之后,亚组之间的抗氧化能力均无差异。平均抗氧化能力在实验端点上也没有发生显着变化。然而,终点抗氧化能力与第二个区块中焦虑患者的反应时间负相关(在其中出现了错误的反馈作为令人沮丧的因素)。镁最初在焦虑参与者组中的显着较高,并且在实验终点下减少。在健康的患者中,端点没有唾液镁变化。总而言之,与健康个体相比,GAD患者的氧化代谢和镁的补偿潜力是在额外的心理情感压力上花费的,但是在实验性令人沮丧的暴露期间避免疲惫是很舒服的。
健康和疾病中新型炎症标志物纤溶酶原激活剂抑制剂-1 的唾液表达:一项介入研究
简介 牙周炎是一种慢性牙周炎症,由致病菌与其他危险因素共同引起。糖尿病与牙周炎呈负相关,是全球重大的健康问题(Preshaw 和 Bissett,2019 年;Kim 和 Amar,2006 年)。牙周病会引发逐渐的、不可逆的炎症反应,从而破坏组织。与牙菌斑生物膜中存在的细菌菌群相反,局部组织和免疫细胞会产生促炎细胞因子,导致牙周组织损伤(Ebersole 等人,2013 年)。代谢紊乱糖尿病 (DM) 的特征是胰岛素分泌不足、胰岛素无效或两者兼而有之引起的高血糖症。牙周组织也是受 DM 影响的众多身体器官之一。这两种情况都会对牙周组织产生负面影响,
基于唾液的无细胞线粒体DNA水平是一种独立的预后生物标志物,适用于头颈鳞状细胞癌
摘要:无细胞核DNA的拷贝数(CF-NDNA)和无细胞的线粒体DNA(CF-MTDNA)的变化显示出在头部和颈部鳞状细胞癌(HNSCC)患者中表现出了有希望的诊断公用事业。考虑到没有用于HNSCC监视的客观预后工具,本研究旨在评估基于唾液的CF-NDNA和CF-MTDNA在预测HNSCC患者总体存活方面的实用性。这项研究包括94例患者的HNSCC诊断,平均随访时间为32.04个月(±19.1)。从每位患者中收集了基于唾液的液体活检。使用多重定量PCR来确定CF-NDNA和CF-MTDNA的绝对数量。使用Kaplan -Meier估计量和COX比例危害回归模型来评估总体生存。死者患者的CF-NDNA和CF-MTDNA的绝对拷贝数在统计学上明显高于审查患者中的CF-NDNA和CF-MTDNA的绝对拷贝数(p <0.05)。CF-NDNA或CF-MTDNA水平升高的个体与总体生存率明显差有关(P≤0.05)。单变量分析表明,只有CF-MTDNA的绝对拷贝数是总生存期的唯一预测指标。然而,多元分析表明,CF-NDNA的所有绝对拷贝数,CF-MTDNA的绝对拷贝数和HNSCC阶段都是总体存活率的预测指标。我们的研究证实了唾液是一种可靠且无创的数据来源,可用于预测HNSCC患者的总体存活,其中CF-MTDNA水平是唯一的预测因子。
横向流动生物传感器(LFB)用于快速检测传染病和唾液作为诊断生物流体的Norjihada Izzah Ismail 1,2*,Pavithira
识别膜中的识别元素称为反应区域或检测位点(Anfossi等,2018; Tang等人。2022)。典型的LFB或称为侧向流动装置(LFD),侧向流程测试条(LFTS),侧向流量免疫测定(LFIA)或免疫色谱测定法(ICA)由四个被称为样品垫,结合垫,硝基纤维素垫和吸收垫(Huangent Pad)组成的四个部分。在检测膜上至少存在两个反应位点,其中对选择性抗体进行排列以产生测试和控制线。由于其成本较低,快速检测,非熟练工人使用的适应性,可移植性,多重能力和易于分析程序,因此,LFB引起了很大的兴趣,作为生物学研究和临床诊断的快速检测方法(Liu等人,2018年)。
na+/i-在非...
在过去的80年中,放射性碘(131 I)已被用来消融甲状腺组织,而不是通过手术去除或治疗已转移到人体其他部位的分化甲状腺癌。然而,在几种非甲状腺组织中也表达了将活性碘化物摄取到甲状腺卵泡细胞中的Na + /i-分类器(NIS)。这种NIS表达允许在这些非目标组织中131 I的积累和辐射损伤,这是放射性碘治疗的不良影响。我们将审查有关非甲状腺组织中NIS的表达,功能和调节的数据,并解释131 I引起的看似矛盾的不良反应,与131 I治疗后的永久性唾液功能障碍相比,自我有限的胃肠道不良反应与永久性唾液功能障碍相反。我们提出需要前瞻性研究来揭示开发和进展的病理过程的时间顺序,或者是131 I诱导的唾液导管阻塞和鼻腔泪管阻塞的最终分辨率。最后,将讨论可以采用可能采用的预防措施和早期治疗干预措施,以消除或减轻长期放射性碘不良反应。