XiaoMi-AI文件搜索系统
World File Search System靶向小窝以将TGF-β的双特异性抗体泵入患病的肺中,使超剂量治疗功效2
(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此预印本版本的版权持有人发布于2022年9月15日。 https://doi.org/10.1101/2022.09.12.507679 doi:Biorxiv Preprint
系统性抗生素使用和潜在药物相互作用的模式:通过Ankara University Hospitals的Apoint患病率进行评估
1。简介除了缺乏新的抗生素外,对可用药物的抵抗的公认危险还需要在医院和门诊环境中合理使用抗生素。疾病控制与预防中心(CDC)的一项回顾性研究报告说,在2006年至2012年之间,55%的患者在住院期间使用至少一剂抗生素[1]。社区获得性和医院感染需要多药治疗。临床医生不能冒险未达到抗生素药物的最大效率。使用所谓的“最后一度”抗生素时,这变得更加明显。考虑到大多数住院患者正在使用多种合并症药物,可能的药物相互作用成为
FLT3特异性抗体-药物偶联物用于治疗急性髓系白血病
3.1.3 抗 FLT3 抗体的结合和内化效率 53 3.1.4 抗 FLT3 抗体的表位定位 55 3.1.5 抗 FLT3 抗体 20D9 的结合分析 56 3.1.6 选择主要候选药物 58 3.2 20D9 抗体-药物-偶联物的生成和表征 59 3.2.1 P5 偶联 59 3.2.2 20D9-ADC 的储存和热稳定性 60 3.2.3 20D9-ADC 在 Ba/F3 细胞模型中对 FLT3 的细胞毒性 60 3.2.4 20D9-ADC 的 FLT3 依赖性和 Fc 受体依赖性细胞毒性 62 3.3 20D9-ADC 在 AML 细胞系中的体外细胞毒活性 64 3.3.1 白血病和淋巴瘤细胞中的靶受体表达系 64 3.3.2 20D9-ADC 在白血病和淋巴瘤细胞系中的细胞毒性 65 3.3.3 20D9-ADC 在 AML 细胞系中的 FLT3 依赖性和 Fc 受体依赖性细胞毒性 68 3.4 20D9-ADC 在 AML 小鼠模型中的体内抗白血病活性 70 3.4.1 20D9-ADC 在 MOLM-13 小鼠模型中的体内活性评估 70 3.4.2 20D9-ADC 在患者来源的异种移植小鼠模型中的体内活性评估 72 3.5 20D9-ADC 在人类 CD34 阳性细胞中的血液毒性 75 3.6 20D9-ADC 和 TKI 的治疗组合 77 3.6.1 TKI 治疗后 FLT3 的上调 77 3.6.2 细胞系与 FLT3 的体外联合治疗ADC 和 TKI 78 3.6.3 用 FLT3 ADC 和 TKI 体内联合治疗细胞系 79
利用双特异性抗体靶向髓系细胞作为癌症的新型免疫疗法
摘要 简介:大多数双特异性抗体 (BsAb) 疗法专注于刺激适应性免疫系统,特别是 T 细胞,以促进肿瘤细胞杀伤。促进肿瘤根除的另一种方法是通过髓系细胞(包括巨噬细胞和中性粒细胞)的参与,这些细胞大量存在并具有杀死肿瘤细胞的内在细胞毒性机制,使它们成为 BsAb 疗法中值得招募的效应细胞。 涵盖的领域:在本综述中,我们描述了科学文献中关于巨噬细胞和中性粒细胞在癌症中的作用的不断发展的知识。此外,我们还讨论了多年来开发的 BsAb,用于招募这些细胞类型作为癌症免疫疗法中的效应细胞。其中包括针对Fc受体(即FcγR和FcαRI)诱导巨噬细胞的抗体依赖性细胞吞噬作用(ADCP)或中性粒细胞的吞噬作用的BsAb的讨论,以及干扰检查点抑制的BsAb,包括SIRPα-CD47通路。专家意见:阐明癌症中巨噬细胞和中性粒细胞异质性的复杂性可能有助于通过靶向Fc受体和检查点通路特异性地发挥这些细胞的细胞毒性能力,从而进一步增强抗癌免疫力。
3D 模型作为评估治疗性抗体抗肿瘤疗效的工具:优势与局限性
摘要:治疗性单克隆抗体 (mAb) 是临床肿瘤学中一个新兴且非常活跃的前沿领域,目前有数百种分子正在使用或测试中。这些治疗方法已经彻底改变了实体和血液系统恶性肿瘤的临床结果。然而,目前确定最有可能从 mAb 治疗中受益的患者是一项挑战,并限制了此类疗法的影响。为了克服这个问题,并实现 mAb 疗法的期望,迫切需要开发适当的培养模型,能够忠实地再现肿瘤与其周围原生微环境 (TME) 之间的相互作用。三维 (3D) 模型允许在患者特定环境中评估药物对 TME 内肿瘤的影响,这是一种有希望的途径,可以逐步填补传统 2D 培养和动物模型之间的空白,为实现个性化医疗做出重大贡献。本综述旨在简要概述目前可用的 3D 模型,以及它们在治疗性 mAb 测试中的具体应用、潜在优势以及在临床前肿瘤学中更广泛应用的当前局限性。
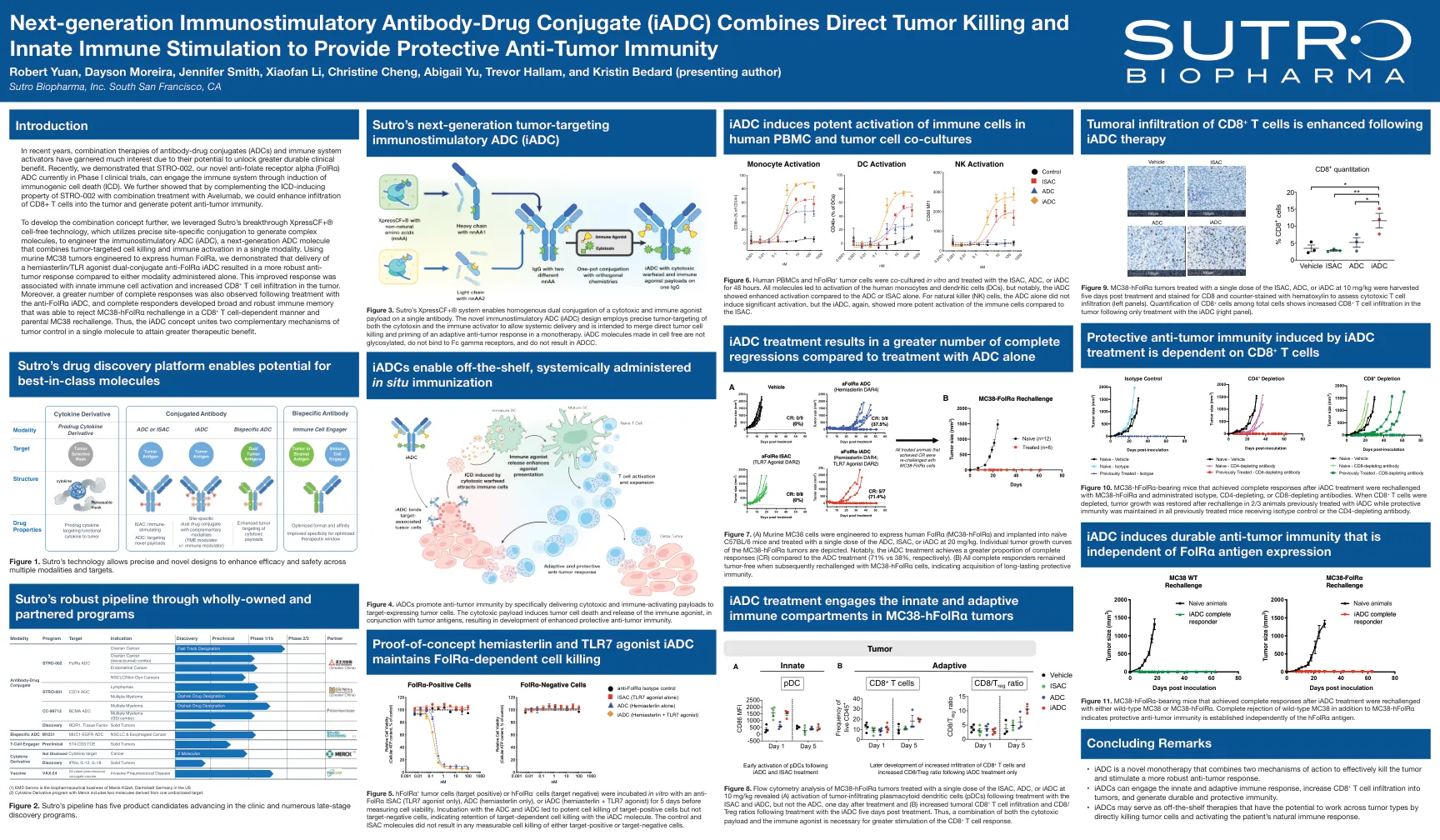
下一代免疫刺激抗体-药物偶联物 (iADC) 结合直接肿瘤杀伤和先天免疫刺激,提供保护性抗
为了进一步开发组合概念,我们利用 Sutro 的突破性 XpressCF+® 无细胞技术,该技术利用精确的位点特异性结合来生成复杂分子,以设计免疫刺激性 ADC (iADC),这是一种将肿瘤靶向细胞杀伤和免疫激活结合在单一模式中的下一代 ADC 分子。使用经过设计以表达人类 FolRa 的小鼠 MC38 肿瘤,我们证明,与单独使用任何一种方式相比,使用半胱氨酸/TLR 激动剂双结合抗 FolRα iADC 可产生更强大的抗肿瘤反应。这种改善的反应与先天免疫细胞激活和肿瘤中 CD8 + T 细胞浸润增加有关。此外,在使用抗 FolRα iADC 治疗后还观察到了更多完全反应,完全反应者形成了广泛而强大的免疫记忆,能够以 CD8 + T 细胞依赖的方式拒绝 MC38-hFolRα 再挑战和亲本 MC38 再挑战。因此,iADC 概念将两种互补的肿瘤控制机制结合在单个分子中,以获得更大的治疗效益。
生成针对双特异性抗体药物偶联物...
摘要 抗体药物偶联物(ADC)疗法已成为癌症免疫治疗中最有前途的方法之一。双特异性靶向可以提高 ADC 分子的特异性、亲和力和内化。催乳素受体(PRLR)和 HER2 在乳腺癌中存在串扰信号传导,与 HER2 相比,PRLR 经历了更快的内化。为了提高 HER2 ADC 的疗效并增强靶标特异性和内化,我们构建了 PRLR/HER2 靶向双特异性 ADC(BsADC)。我们从亲和力和内化方面评估了 PRLR HER2 BsADC 的表征,并使用 Cell Count Kit-8 分析进一步评估了其在人乳腺癌细胞系(BT474、T47D 和 MDA-MB-231)中的体外细胞毒性。我们的数据表明,PRLR HER2 BsADC 在结合药物后保持对两种靶向抗原的亲和力,并且与 HER2 ADC 相比表现出更高的内化效率。此外,PRLR HER2 BsADC 在体外对人类乳腺癌表现出优异的抗肿瘤活性。总之,我们的研究结果表明,通过增加靶向抗体的内化来增强抗肿瘤活性和治疗潜力是可行的,可以在体内动物模型中进一步评估。
拮抗性抗体 BI-1206 靶向 FcγRIIB 可提高以利妥昔单抗为基础的疗法治疗侵袭性套细胞淋巴瘤的疗效
摘要尽管 FDA 批准了多种靶向疗法和免疫疗法,但不可避免的复发仍然是套细胞淋巴瘤 (MCL) 患者的主要治疗挑战。Fc γ 受体 (FcγR) 在调节抗体介导的免疫中起重要作用。FcγRIIB 是 FcγR 家族中独特的免疫检查点抑制成员,与免疫细胞脱敏和肿瘤细胞对抗 CD20 抗体利妥昔单抗和其他抗体介导的免疫疗法的耐药性有关;然而,人们对其在侵袭性 MCL 患者,尤其是具有多重耐药性的患者中的表达及其免疫调节功能知之甚少。在本研究中,我们发现 FcγRIIB 在 MCL 细胞系和原发性患者样本中普遍表达。与未接受伊布替尼/利妥昔单抗治疗、敏感或耐药的样本相比,CAR T 复发患者样本中的 FcγRIIB 表达显着更高(p < 0.0001)。利妥昔单抗诱导的 JeKo-1 细胞 CD20 内化可通过同时使用 BI-1206(一种针对 FcγRIIB 的重组人单克隆抗体)完全阻断。利妥昔单抗-伊布替尼、利妥昔单抗-维奈克拉和利妥昔单抗-CHOP 的联合治疗也诱导了 CD20 内化,而 BI-1206 再次有效阻断了这种内化。在 JeKo-1 细胞系衍生的异种移植模型中,BI-1206 显著增强了利妥昔单抗-伊布替尼 (p = 0.05) 和利妥昔单抗-维奈克拉 (p = 0.02) 的体内抗 MCL 功效,但没有增强利妥昔单抗-CHOP 组合。在患者来源的异种移植 (PDX) 模型中,BI-1206 作为单一药物,在一种对伊布替尼和维奈克拉均有耐药性但对利妥昔单抗和来那度胺 (R 2 疗法的临床前模拟物) 组合敏感的侵袭性 PDX 模型中表现出高效力(p < 0.0001)。BI-1206 在对利妥昔单抗、伊布替尼和 CAR T 疗法具有三重耐药性的 PDX 模型中增强了利妥昔单抗单药疗法的疗效 (p = 0.030)。此外,BI-1206 显着增强了利妥昔单抗-维奈克拉组合的疗效 (p < 0.05),这导致 25% 的小鼠的肿瘤长期缓解。总而言之,这些数据表明,针对这种新的免疫检查点阻断可增强利妥昔单抗方案在具有多重耐药性的侵袭性 MCL 模型中的治疗活性。关键词:FcγRIIB、BI-1206、CAR-T、治疗耐药性、套细胞淋巴瘤、联合治疗
RB1,癌症谱系可塑性和治疗性抗性
谱系可塑性,即细胞切换谱系限制基因的能力。癌症谱系可塑性越来越多地视为抗治疗的一种机制,尤其是分子靶向疗法。这些疗法通常将其优势效果归功于其治疗靶标的谱系限制性,因此癌症可以通过改变谱系状态来逃避此类疗法。由于部署了越来越有效的分子靶向疗法,因此癌症谱系可塑性可能是一个越来越多的临床问题。谱系可塑性反映了一种不可逆转的转录适应性,但致癌遗传突变可能会驱动典型的癌细胞的谱系可塑性升高。在此提出了与癌症谱系可塑性相关的关键概念,审查了RB1肿瘤抑制基因在驱动癌症谱系可塑性中的丧失的证据,并讨论了对抗癌症谱系可塑性的可能治疗方法。
有希望的选择性抗癌治疗策略
Z,Rustemi,博士论文 Maxsim2 - 用于测试药代动力学和药效学的实时交互式计算机模拟 由瑞典哥德堡弗劳恩霍夫-查尔姆斯中心系统和数据分析系的 Mats Jirstrand 提供