XiaoMi-AI文件搜索系统
World File Search System人道主义教育研讨会 - 我们...
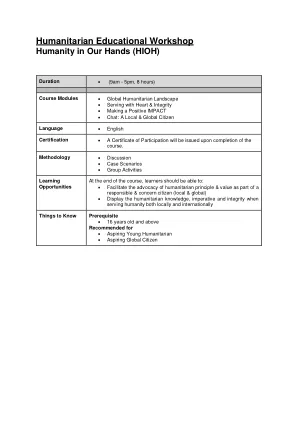
学习成果1。展示了对具有正直的负责任的年轻人道主义者的必要属性的理解。2。确定在国际,国家和社区/个人层面上有效地为人类外交所需的必要技能
医学研究中的人道胚胎
研究人类胚胎 Meine Damen 和 Herren,所以研究人类胚胎,在 einer Reihe von Ländern durchgeführt wird – Frau Bundesministerin hat es schon angedeut – und von deren Ergeb nissen auch wirprofitieren,在德国 ebenfalls erlaubt werden?是否有任何问题? Der deutsche Gesetzgeber fand im Jahr 1990 mit dem dem Embryonenschutzgesetz eine klare Antwort auf die Frage, nämlich: An menschlichen Embryonen sollte NICHT geforscht werden dürfen. 30 年前的战争是一场充满活力的科学与社会辩论。 Deshalb nahm sich der Gesetzgeber damals vor, in regelmäßigen Abständen das Gesetz zu überprüfen und Gegebenenfalls anzupassen. Leider müssen wir feststellen, dass dies nicht passiert ist, and ich kann nur über die Gründe mutmaßen.
2000 年的人道协调厅
由复杂的紧急响应分支在 Ernest Chipman 的指导下编写 主编:SILVIA FERAZZI 编辑顾问:MARILLYN A CHIRON 技术协助:LUCIANO NATALE, ROSA罗塞蒂,丽贝卡TONGOL 封面照片:M. E LMQUIST、E. H AEGGLUND 和 C. P EREIRA 其他照片:D.C HIKWAZIDWE (第 8 页)、G. H Ovannisyan (第 18 页)、G. D IFFIDENTI (第 23 页) ),救济网(第 29 页),M. ELMQUIST ( P .30),联合国开发计划署 (第 33 页) OCHA(第 38 页)、M. N INABER VAN E YBEN(第 44 页)、儿童基金会 /M. R ASIC(第 60 页)、难民署 /R. C HALASANI(第 60 页)、A. Y AFTALI(第 69 页)、J. L UND(第 76 页)、OCHA P ISA(第 87 页)、ISDR(第 90 页) 地图由 OCHA R ELIEF W EB 和 DPI C 制图部门制作 新本文件中包含的 Y ORK 财务数据由执行办公室和财务及行政部门提供
Anwar Ibrahim的“人道经济”的制作
•马来西亚副总理安瓦尔·易卜拉欣(Anwar Ibrahim),1993 - 98年,反对派领导人,2008 - 15年,自2020年3月以来,与两张持久的,看似矛盾的图像有关。那些是年轻的安瓦尔(Anwar),是一种激进的伊斯兰主义者,经济学似乎并不重要,作为1997年东亚金融危机期间的亲市场改革家,伊斯兰教不再对此无所事事。•然而,年轻的安瓦尔伊斯兰教中有经济学,相反,伊斯兰教在成熟的人的经济学中。他们之间存在某些“道德矛盾”,这些“道德矛盾”在危机前占据了安瓦尔,当时经济增长,繁荣和野心被寻租,腐败和机构退化所困扰。•安瓦尔(Anwar)对“伊斯兰教和经济学”表达了各种想法,尤其是当他担任马来西亚盎格鲁·伊斯兰教伊斯兰教(Abim,或马来西亚伊斯兰青年运动),财政部长(1991 - 98年)和后革命后反对派的领导人时。他的思想构成了“人道经济”的核心,他从2006年开始重返积极政治时就主张并主张。•“人道经济”的愿景在马来西亚历史上的特定政治联系中具有个人,意识形态和政治意义。
AVMA 动物人道屠宰指南
《人道屠宰指南》强调了美国兽医协会的道德和专业承诺,即在尽可能的情况下,不会在屠宰前和屠宰过程中对有意识的动物造成不必要的痛苦、伤害或痛苦。“痛苦或压力大的死亡可能会掩盖或负面影响之前的一切。”5 从伦理角度评估养殖实践和屠宰方法时,仔细注意经验观察至关重要。美国兽医协会鼓励其成员和从业人员利用他们的科学知识、实践专业知识和合理的道德判断来保护和促进所有动物的健康和福利。因此,通过更多地与兽医专业和专业人士接触,可以改善食用动物的福利;不断发展基于科学的人道屠宰方法和动物福利方法;制定关于治疗多种类别的受伤、生病或流离失所动物的明确行业政策;对处理和屠宰动物的人员进行培训和问责;增加公众参与和教育,以提高动物护理和福利实践以及屠宰方法的透明度;以及协调地方、州和国家监管政策和监督机制与符合道德标准的护理标准。食品和纤维行业利益相关者之间的持续合作将有助于加强最佳实践,并改善动物福利和屠宰结果。
2001 年人道协调厅
2001 年,我们将继续以同样的决心与我们的人道主义、人权、发展、维持和平和政治伙伴一道努力,使人道主义需求成为联合国应对危机的核心。我们最重要的任务之一将是执行秘书长去年 11 月发起的联合呼吁,旨在帮助全世界 3500 多万弱势群体。另一个优先事项是根据对受国内流离失所者影响国家的行动进行高级别机构间审查的结果,加强联合国向国内流离失所者提供援助和保护的能力。在我们的财政资源范围内,我们还将执行内部审查的建议,以改善我们对实地的支持,加强我们迅速有效地应对危机的能力,并巩固我们对自然灾害和复杂紧急情况的应对能力。
培训和行为课 - 俄勒冈人道社会
预防措施:狗喜欢吃猫食。您应该将猫食物从狗的范围内(在壁橱或高架上)保持范围。吃猫粪便在狗中也是相对常见的行为。这种行为可能对您不利,这也让您的猫感到不满,因为它具有入侵垃圾箱的重要空间。不幸的是,试图通过“ Booby Trappapping”将您的狗从垃圾箱中脱离垃圾箱,也将使您的猫远离,事实后的惩罚不会改变您的狗的行为。最好的解决方案是将垃圾箱放置在您的狗无法访问的垃圾箱中:根据您的狗和猫的敏捷性,您可以在婴儿大门后面尝试,在壁橱里,门从两侧固定在门的壁橱中,距离猫足够宽,或者在底部有猫门的房间内。有很多解决方案解决此问题,因此请致电更多建议。
人道社会健康诊所明信片 2024。......
全面健康护理套餐 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15美元
联合国军民协调 - 人道协调厅
人道主义援助的军民协调是多方面的且不断发展。这项工作的范围从救灾中外国军事资产 (FMA) 的现场协调到冲突局势中所需领土的准入谈判。联合国人道主义活动军民协调(UN-CMCoord)职能传统上是协调救灾过程中军事和民事保护资源的部署,自国际救灾人员创建以来,它已以适应一系列的发展。政府越来越频繁地部署军事力量,作为在发生自然灾害时提供国际援助的一部分。在国家层面,一国的武装部队也经常承担急救责任。随着维和与建设和平行动的一体化和日益复杂,军民协调职能逐渐成为人道主义界与联合国和地区维和行动军事资源之间的重要接口。 “军民援助协调员的态度
研究和分析果糖中的人道终点...
1 laqv-requin, department of chemistry, University of Aveiro, 3810-193 Aveiro, Portugal 2 Citab Inov4Agro-Institute for Innovation, Capacity Building and Sustainability of Agri-Food Production, University of T-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 3 Department of Zootechnics, Ol of Sciences and Technology, University of is Vora, 7000-812 is Vora, Portugal 4 Comprahensive Health Research Center, 7000-812 is Vora, Portugal 5 Engineering Department, University of T-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 6 Institute for Systems and Computer Engineering, Technology and Science, 4200-465 PORTO, Portugal 7 Animal and Veterinary Research Center (CECAV), University of Tr to S-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 8 Department of Veterinary Sciences, University of Tr to S-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal * correspondence: pamo@utad.pt1 laqv-requin, department of chemistry, University of Aveiro, 3810-193 Aveiro, Portugal 2 Citab Inov4Agro-Institute for Innovation, Capacity Building and Sustainability of Agri-Food Production, University of T-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 3 Department of Zootechnics, Ol of Sciences and Technology, University of is Vora, 7000-812 is Vora, Portugal 4 Comprahensive Health Research Center, 7000-812 is Vora, Portugal 5 Engineering Department, University of T-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 6 Institute for Systems and Computer Engineering, Technology and Science, 4200-465 PORTO, Portugal 7 Animal and Veterinary Research Center (CECAV), University of Tr to S-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal 8 Department of Veterinary Sciences, University of Tr to S-os-Montes and Alto Douro, 5000-801 Vila Real, Portugal * correspondence: pamo@utad.pt